1. 서 론
2. 재료 및 방법
2.1 해양선충류 채집 및 분리
2.2 해양선충류 선정
2.3 배양 배지 제작 및 먹이 배양
2.4 선충류 배양 실험
3. 결과 및 고찰
3.1 Enoplolaimus sp.의 생존 적합배지 선정
3.2 Bathylaimus sp.의 생존 적합배지 선정
3.3 Bathylaimus sp.의 산란 및 부화 배양 실험
1. 서 론
독립생활을 하는 선충류는 여러 해양 및 기수역 서식지의 저서생물 중 개체수가 매우 많은 대표적인 후생동물이며, 서식밀도는 수만~수십만inds.m-2 까지에 이르며 생체량은 0.1~10 g cm-2로 알려져 있다(Heip et al., 1985; Soetaert et al., 1995). 해양 선충류의 섭식 활동은 저서미세조류와 박테리아에 직접적으로 영향을 미치는 등 전체적인 생태계 기능에 상당 부분 기여를 하는 것으로 알려져 있으며(Moens and Vincx, 1998; Coull, 1999; Franco et al., 2010), 해양 선충류의 생물혼탁작용은 산소를 포함하여 다양한 용질이 포함된 퇴적물의 확산율에도 영향을 미치고(Aller and Aller, 1992; Alkemade et al., 1992), 퇴적물 표면의 미생물 분해 작용 강화에 영향을 미칠 가능성이 있다고 알려져 왔다(Nehring et al., 1990; Moens and Vincx, 1999). 또한 해양 선충류의 점액 분비물은 다양한 미소 생물들을 위한 기질로 이용되며(Gerlach and Schrage, 1969; Hamerlynck and Vanreuse, 1993; Rienmann and Schrage, 1978), 해저 또는 초심해저에서 포식자의 먹이원으로서의 역할을 하는 것으로 알려져 있다(Bell and Coull, 1978; Coull, 1990; Moen and Vincx, 1998). 하지만 저서생태계의 먹이망에서의 해양 선충류의 역할에 대해서는 극히 적은 부분만이 알려져 있다(Moens et al., 2005a).
이러한 해양 선충류의 생활사나 저서 생태계에서의 생리 ‧ 생태적인 역할 또는 먹이망에서의 역할 등에 대한 연구는 매우 적으며, 이는 자연 상태에서의 해양 선충류의 생활사에 대한 연구를 실험실 내에서 수행하기 어려움에 기인한다. 대부분의 해양과 기수역의 선충류들의 성 성숙은 온도나 먹이 등의 다양한 외부 요소들에 의해서 며칠, 몇 주, 또는 몇 달의 시간 동안 발달하며 이루어진다는 사실은 소수의 연구에 의하여 알려진 바 있다(Gerlach and Schrage, 1971, 1972; Heip, 1978). 국외에 서식하는 해양선충류의 배양이나 발생 그리고 생활사 등의 연구는 극히 수 종에 지나지 않으며, 그것도 근년에 이르러서야 지역 특색을 보이는 결과들이 발표되고 있다(Herman and Vracken, 1988; Moens and Vincx, 1998; Moens and Vincx, 2000a,b; Houthoofd et al., 2003; Mesel et al., 2003; Moens et al., 2005b; Lahl et al., 2006; Mesel et al., 2006; Fonseca et al., 2008; Singh and Ingole, 2011).
선충류의 종 특성은 서식하는 해역이나 환경에 따라 많은 차이를 보이는 것이 일반적이라 할 수 있다. 따라서 우리나라 연안역 종을 대상으로 그 특성을 밝힐 필요가 있음에도, 국내 서식하는 해양선충류들의 생리 ‧ 생태적 연구는 매우 부족하며, 이러한 생리 ‧ 생태 등에 이용할 수 있는 해양선충류를 단일종으로 대량 배양하는 연구는 국내에서 거의 이루어지지 않고 있다.
본 연구에서는 국내에 서식하는 해양선충류의 생활사 연구 및 해양선충류를 이용한 생리 실험 등에 이용할 수 있도록 국내 서식 해양선충류를 대량 배양하는 것을 목적으로 해양선충류가 생존하기에 최적의 조건을 갖는 배지의 개발을 목표로 하였으며, 기존의 해양선충류 배양에서 많이 사용되었던 Killian 배지(Moens and Vincx, 1998)를 기본으로 한 여러 종류의 첨가물들을 첨가시킨 배지를 제작하였다. 제작한 배지를 이용하여 국내 해양선충류의 배양에 적합한 배지 조성을 찾고자 하였고, 제작된 배지를 이용하여 해양선충류의 산란과 발달, 그리고 부화하는 과정에 대하여 알아보고자 하였다.
2. 재료 및 방법
2.1 해양선충류 채집 및 분리
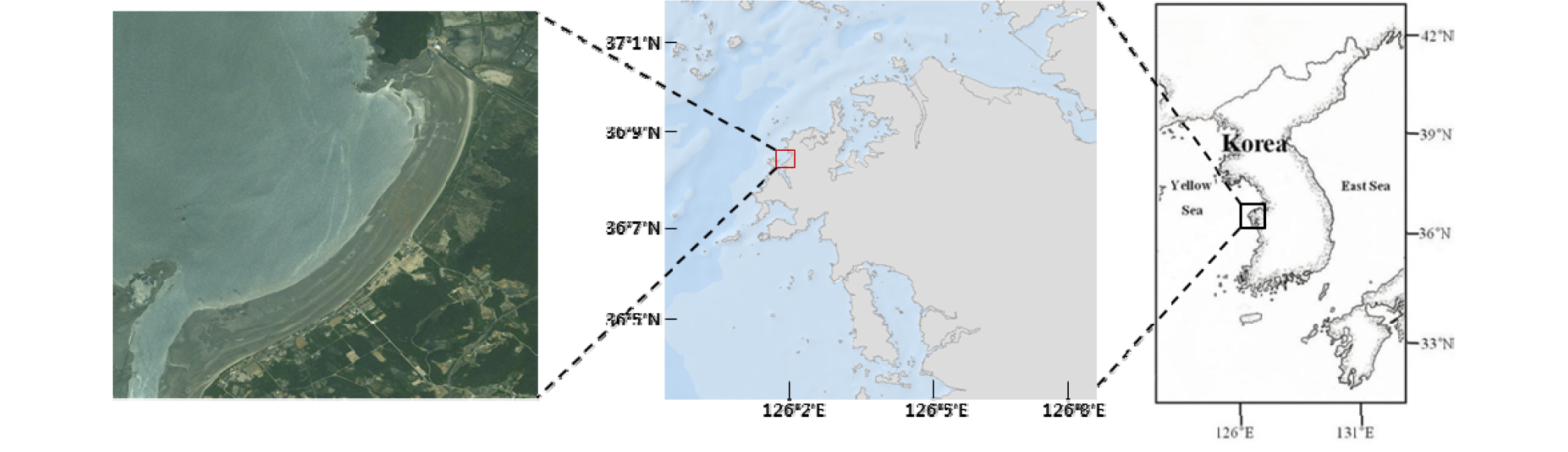
배양에 사용할 선충류를 확보하기 위하여 태안 만리포 조간대 지역(Fig. 1)에서 2013년 가을부터 2016년 여름에 이르기까지 평균 약 3개월에 한 번씩 표층에서부터 5 cm의 퇴적물을 채집하여 아이스박스에 넣어 실험실로 이동하였다. 채집한 퇴적물에 7.5% MgCl2를 혼합하여 생물을 마취하여 건져낸 후 다시 멸균 해수에 담그는 방식으로 퇴적물에서 생물을 분리하였다. 배양에 이용한 선충류들은 해부현미경 하에서 추출하여 멸균 해수로 3회 씻어낸 뒤, 한천 배지로 채워진 페트리디쉬로 옮겨서 실험을 진행하였다.
2.2 해양선충류 선정
해양 선충류의 배양에 적절한 배지 배합을 알아내기 위하여 총 9번의 실험을 수행하였다. 실험 1~6까지의 실험에서는 채집한 퇴적물에서 분리된 선충류 중에서 가장 우점하고 개체의 크기가 다른 선충류에 비하여 비교적 큰 Enoplolaimus sp.를 배양 대상종으로 선정하여 적합 배지 실험을 수행하였다. Enoplolaimus sp.의 섭식 유형(feeding type)은 잡식성(omnivores)으로 알려져 있다. 이러한 배지의 선정을 바탕으로 진행된 해양선충류의 산란과 발생, 부화를 관찰하기 위한 실험 7~9를 수행하였고, 산란과 발생 및 부화 관찰 실험에서는 동일 퇴적물에 서식하는 종 중에서 채집 당시에 가장 개체수가 많고 성체 몸 크기가 Enoplolaimus sp.와 유사하며, 같은 식성인 잡식성 중에서 포란 확인이 용이한 Bathylaimus sp.의 암컷을 실험 대상종으로 선정하였다. 각 실험의 조건에 따른 선충류의 생존시간 간의 유의한 차이를 파악하기 위하여 SPSS 19룰 이용하여 분산분석(analysis of variance, ANOVA)을 실시하여 유의성을 검정(95% 신뢰수준)하였다.
2.3 배양 배지 제작 및 먹이 배양
Killian 배지(Moens and Vincx, 1998)는 해양선충류의 크기, 섭식 유형, 서식지의 차이에 관계없이 여러 종의 해양선충류 배양에 이용되고 있다. 본 실험에는 Killian 배지를 다양한 한천 농도에 배지 조성 성분을 추가하는 등, 여러 조건들을 변형하여 배지를 제작하여 실험을 수행하였다(Table 1). 해양선충류의 종에 따라 서식에 적합한 한천의 농도가 다르기 때문에(Moens and Vincx, 1998) 배양실험은 여러 농도로 동시에 진행하였다. 배지 제작에 사용된 멸균 해수의 염분도는 채집지역인 만리포 지역과 유사한 30 psu이었으며, 먹이 생물로는 동일한 채집지역에 서식하는 박테리아를 공급하였다. 박테리아의 배양은 채집해온 퇴적물과 해수를 혼합한 뒤, 해수를 분리하여 1/102 또는 1/104로 희석한 뒤, 희석한 해수를 멸균 해수로 제작한 1.5% 한천배지에 접종하고 유리구슬을 이용하여 도말한 뒤, 30°C에서 배양하였다. 배양 1주일 후, 배지에서 자란 여러 종류의 박테리아를 단일 배양하기 위하여 백금이(loop)를 이용하여 콜로니(colony)를 하나씩 채취하여 멸균 해수에 효모추출물(yeast extract)을 첨가한 1.5% 한천배지에 3분 도말한 후, 30°C 배양기에서 배양하였다. 1주일 후, 멸균된 일회용 유리바이알(BD FalconTM)에, 멸균해수에 2%의 효모추출물을 첨가해 제작한 액체 배지를 약 4~5 ml씩 넣어 주고, 앞서의 배지에서 순수 배양한 박테리아들을 콜로니의 형태와 색깔 등에 따라 분류한 뒤, 우점종을 구분하여 5종을 선별하여 액체배지에 넣어주고 박테리아 배양기에서 3일동안 배양하였다. 박테리아의 대량 배양 후, 일부는 E.P tube에 1~2 ml 씩 넣어 동량의 40% 글리세롤(glycerol)을 첨가하여 -70°C에서 동결 보존하여 보관하였다. 한천의 농도와 먹이의 공급량은 실험에 따라 조금씩 변형하였다.
Table 1. Culture experiment conditions of Enoplolaimus sp. and Bathylimus sp.
2.4 선충류 배양 실험
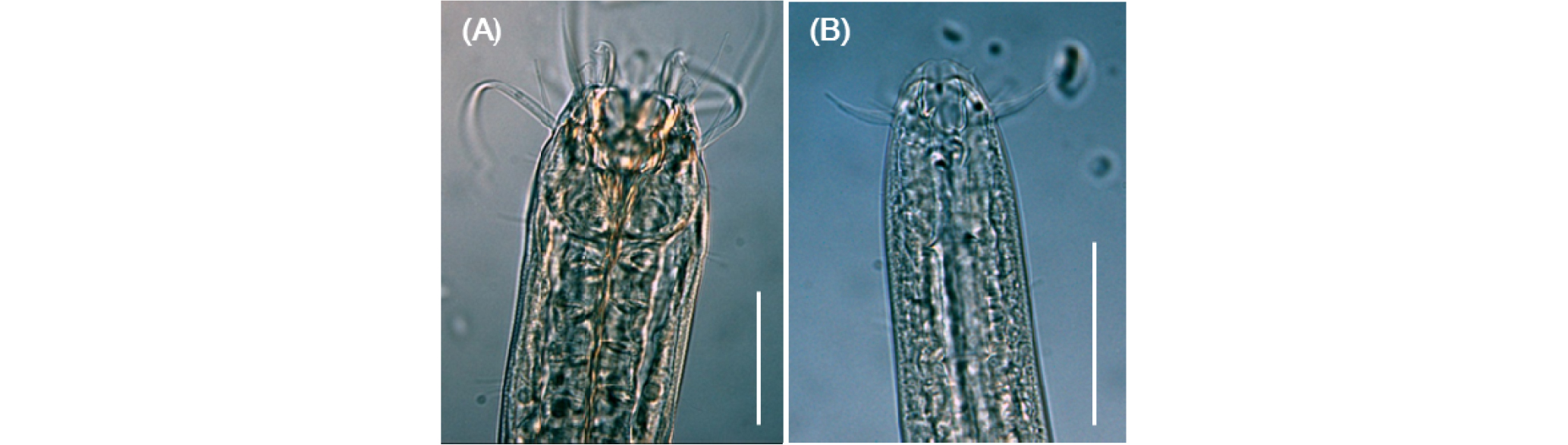
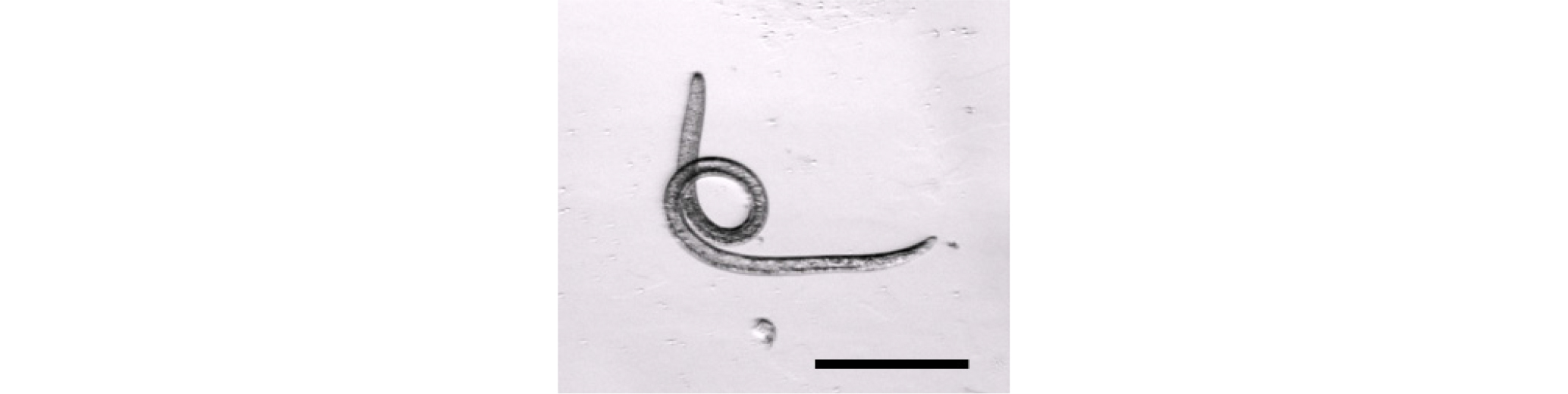
선충류 배양에 적합한 배지를 선정하기 위한 실험은 배지 조성과 한천 농도, 먹이 원인 박테리아의 공급량과 공급 유무에 차이를 두었다. 각 실험은 12시간마다 관찰하여 기록하였다. 실험 1~6은 Enoplolaimus sp. 의 최적의 배지 배양 조건을 찾기 위하여 여러 조건으로 실험하였으며, 각 실험의 조건은 Table 1과 같다. 실험 1~6의 결과를 바탕으로 실험 7~8에서는 Bathylaimus sp.의 생존에 적합한 배지 조건을 찾기 위한 실험을 진행하였으며, 실험 9에서는 Bathylaimus sp.의 산란과 발생 및 부화 과정을 관찰하는 실험을 진행하였다(Table 1). 해부현미경(MZ16, Leica, USA) 하에서 관찰하고 카메라(GS3-U3-91S6C-C, Point Grey Research InC.)를 이용하여 Bathylaimus sp. 성체와 자충, 알의 사진을 촬영하였으며(Figs. 10, 11, 13, 14), 광학현미경(BX51, Olympus, Tokyo, Japan)과 카메라(MDCC560, ScopeTek)로 Enoplolaimus sp.와 Bathylaimus sp.의 구강과 Bathylaimus sp.의 알 사진을 촬영하였다(Figs. 9, 12).
3. 결과 및 고찰
3.1 Enoplolaimus sp.의 생존 적합배지 선정
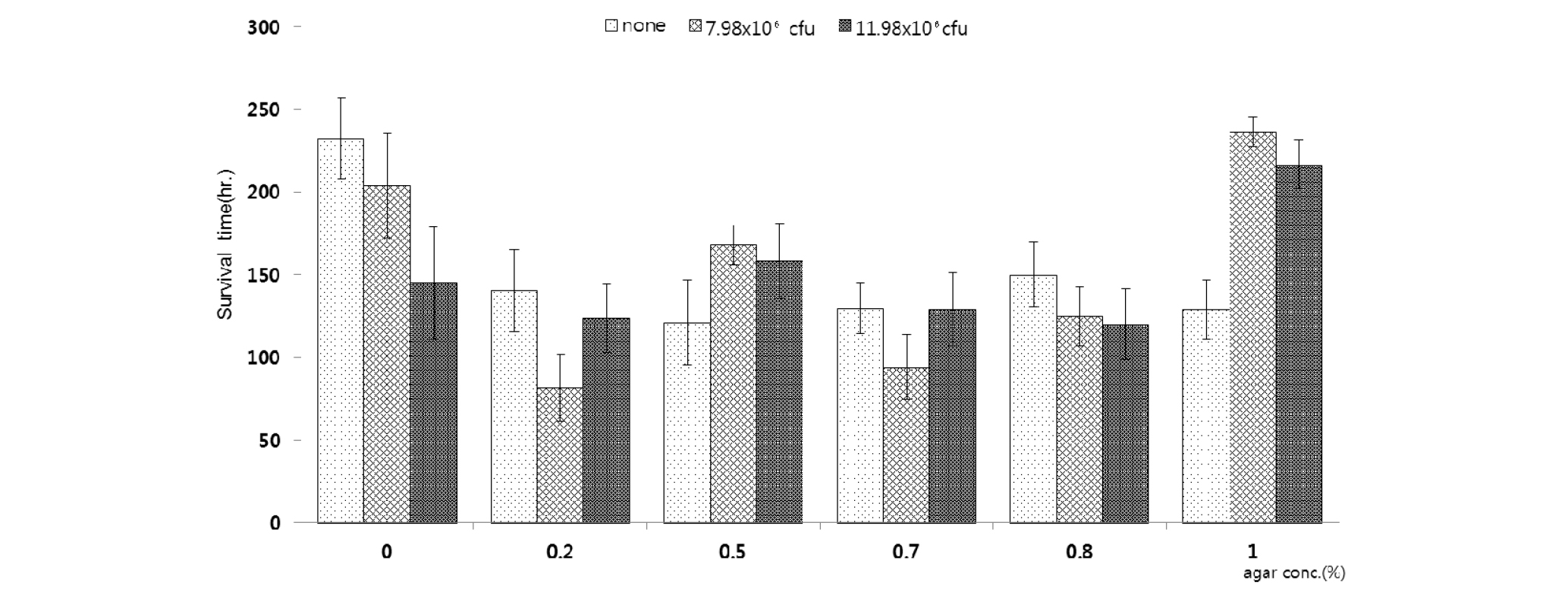
실험 1은 Enoplolaimus sp.를 배양하기에 가장 적합한 한천배지 조건을 찾고자 0, 0.2, 0.5, 0.7, 0.8, 1.0% 농도의 Killian 한천배지를 준비하였고, 먹이인 박테리아의 공급량에도 차이를 두고 온도 20°C, 염분도 30 psu, 암배양 조건으로 실험을 진행하였다(Table 1).
실험 1의 실험 결과, 해양선충류의 생존시간이 평균적으로 가장 높게 나타난 배지는 한천농도 0%와 1.0%의 배양 배지인 것으로 나타났다(Fig. 2). 각 농도의 배지에서 가장 높은 생존시간을 보인 것은 한천농도 1.0%의 배지에 7.98×106 cfu의 박테리아를 분주한 배지였고, 평균 생존시간은 236.4시간으로 나타났다. 그다음으로 높은 생존시간은 한천농도 0%에 박테리아를 분주하지 않은 배지에서 232.2시간으로 나타났다. 가장 낮은 생존시간은 한천농도 0.2%의 배지에 7.98×106 cfu의 박테리아를 분주한 배지에서 81.6시간으로 나타났다.
선충류의 생존시간은 배지의 한천 농도에서 유의한 차이가 나타났고(P<0.05), 박테리아 분주량에 대해서는 유의한 차이가 없었다(P>0.05). 그러나 한천 농도별 박테리아 분주량에 따른 선충류의 생존시간에 대해서는 유의한 차이를 보였다(P<0.05). 평균 생존시간이 가장 높았던 한천농도 0% 배지에서는 먹이 공급량이 증가할수록 생존시간이 감소하였고, 한천농도 1.0% 배지에서는 먹이 공급을 하지 않은 배지에 비하여 먹이 공급을 한 배지에서 생존시간이 매우 증가하는 결과를 나타내었다. 이는 한천의 농도, 공급이 되어지는 먹이의 유무와 선충류 종 특이성이 연관이 있다는 연구와 일치하는 결과라고 생각된다(Moen and Vincx, 1988). 어떠한 조건이 국내에 서식하는 해양선충류들의 실험실 내 배양에서 생존율을 높일 수 있는지에 대한 연구가 매우 부족하기 때문에 대상종인 Enoplolaimussp.를 배양하기 위한 가장 적합한 한천배지의 농도와 먹이의 공급량 등에 대하여 알아보기 위해 실험 2~6을 차례로 진행하였다.
실험2에서는 온도의 차이가 생존시간에 영향을 미치는지 알아보기 위하여 실험 1에서 평균 생존시간이 가장 길었던 배지인 한천농도 0%와 1.0%에서 온도조건을 20, 25°C으로 설정하여 암배양으로 실험을 진행하였다. 실험 2에서 해양 선충류의 평균 생존시간은 25°C에 비하여 20°C에서 높게 나타났다(Fig. 3). 온도 차이에 따른 평균 생존시간의 차이는 한천농도 1.0%에 비하여 0%에서 비교적 높은 차이를 나타냈고, 온도 변화에 따른 한천 농도에 대해서 유의한 차이를 보였다(P<0.05).
온도 조건 25°C에서 가장 높은 생존 시간을 보인 배지는 먹이 공급을 한 한천농도 1.0%의 배지이며 생존 시간은 214.4시간이고, 가장 낮은 생존 시간은 먹이 공급을 한 한천농도 0%의 배지에서 평균 86.4시간으로 나타났다. 온도 조건 20°C에서 가장 높은 생존 시간을 보인 배지는 먹이 공급을 하지 않은 한천농도 0%의 배지이며 평균 생존 시간은 평균 177.4시간이고, 가장 낮은 생존 시간은 먹이 공급을 한 한천농도 0%의 배지에서 평균 135.6시간으로 나타났다.
온도 차이에 따른 평균 생존시간의 차이는 한천농도 0%에서 비교적 높은 차이를 나타내었는데 이는 온도가 높아짐에 따라 먹이로 공급되었거나 배지에 접종된 해양 선충류의 강모 등에서 유래된 박테리아의 번식량이 늘어났기 때문으로 사료된다. 해양선충류가 기질 내에서 이동하는 활동에 의해서 박테리아도 강모에 의해 운반되며, 이러한 선충류의 이동으로 인하여 기질 내 산소가 활발히 공급되고, 선충류가 분비하는 점액이 박테리아의 증식을 돕는다는 연구 결과가 있다(Alkemade et al., 1992). 또한 점액을 분비하는 선충류와 박테리아가 동종공생(commensalistic) 관계에 있을 것이라는 연구 결과(Riemann and Helmke, 2002)도 실험 2에서의 결과와 관련이 있을 것으로 생각된다. 선충류의 움직임이 비교적 자유로운 0% 농도의 한천 배지에서의 선충류의 활동이 박테리아의 증식을 활발히 진행시켜, 한천 배지가 선충류가 생존하기에 적합하지 않은 상태로 변했을 가능성이 있다. 하지만 매우 낮은 배양 온도(9~12°C)는 박테리아의 성장을 억제시킴과 동시에 선충류의 발달 역시 억제시킬 수 있기 때문에(Gerlach and Schrage, 1971; Hopper et al., 1973), 적정 온도를 유지하는 것이 매우 중요하다고 생각된다.
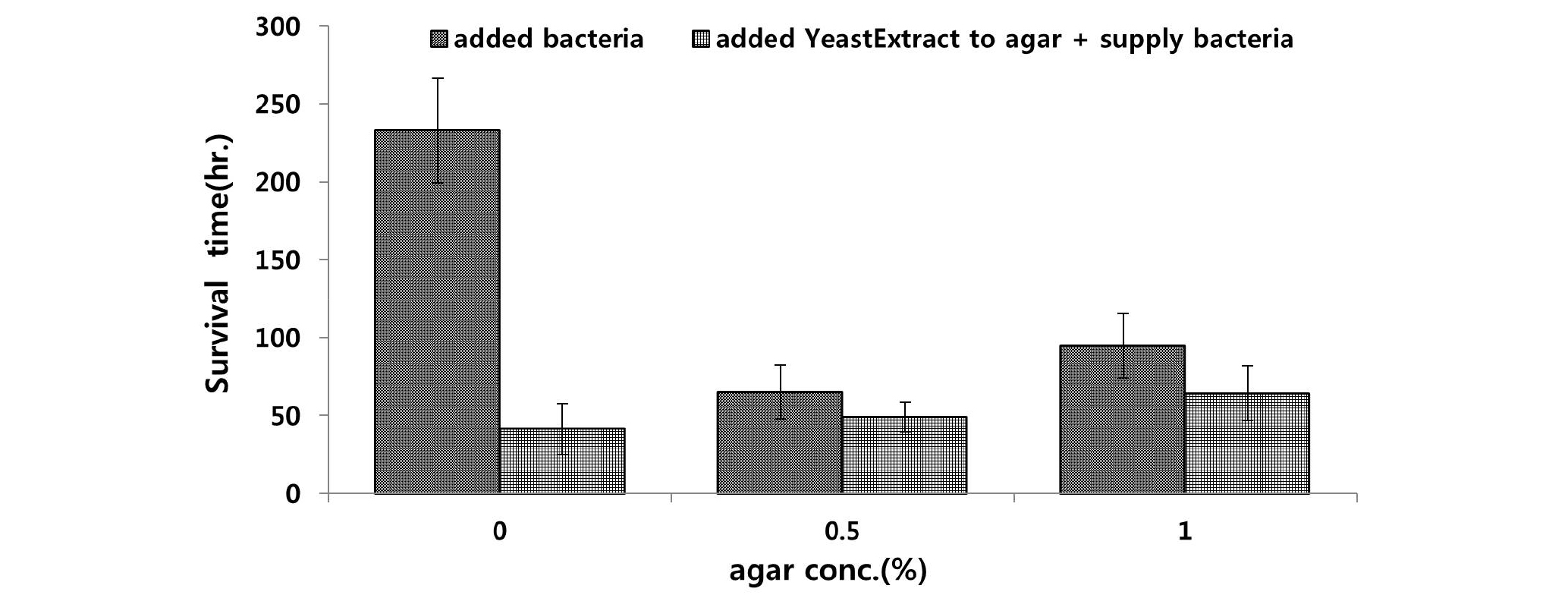
실험3에서는 실험 2에서 온도가 높은 조건에서 박테리아의 번식이 증가하였고, 온도의 증가에 따라 먹이 생물인 박테리아의 농도가 증가함으로써 해양선충류의 생존시간이 짧아졌다는 가정을 확인하기 위하여 박테리아의 성장을 촉진시키는 효모추출물(yeast extract) 첨가한 배지와 첨가하지 않은 배지를 조건으로 설정하였고, 20°C에서 암배양으로 실험을 수행하였다.
한천농도 0, 0.5, 1.0% 배지 모두 박테리아에 영양을 공급하여 성장속도를 높이는 효모추출물을 첨가한 배지에서 가장 낮은 생존 시간을 나타냈고(Fig. 4), 효모 추출물의 첨가 유무와 한천 농도 차이에 따른 선충류의 생존시간은 유의한 차이가 나타났다(P<0.05). 가장 높은 생존 시간은 한천농도 0% 배지에서 평균 233시간으로 나타났고, 가장 낮은 생존 시간은 효모추출물을 첨가한 한천농도 0%에서 41.4시간으로 나타났다. 일반 Killian 한천 배지보다 효모추출물을 첨가한 Killian 한천 배지에서의 해양선충류 생존 시간이 상대적으로 짧아지는 결과를 나타냈다.
선충류 배양 배지 내에서의 산소의 소비는 선충류의 활동에 비하여 박테리아의 활성에 상대적으로 더욱 많은 영향을 받는 것으로 알려져 있다(Alkenmade et al., 1992). 이러한 연구 결과로 미루어보아, 실험 3에서의 결과는 앞서 진행한 실험 2에서와 같이 먹이로 공급되거나 선충류의 강모에 붙어 배지로 이동된 박테리아의 증식으로 인하여 선충류가 접종된 배지의 산소 소비량이 높아져, 배지의 상태가 선충류가 생존하기에 적합하지 않은 환경으로 바뀌었기 때문이라고 생각된다.
실험 4는 배양 실험 시, 선충류의 먹이원으로 공급되는 박테리아에서 선충류의 물질대사에 이용될 수 있는 bacto peptone과 소고기 육즙(beef extract)으로의 대체 가능 여부를 확인하기 위하여 bacto peptone과 소고기 육즙을 첨가한 배지를 제작하여, 이에 박테리아 공급을 추가로 한 배지와 그렇지 않은 배지로 조건을 설정하여 한천농도 0, 0.5, 1.0%로, 20°C에서 암배양으로 실험을 하였다.
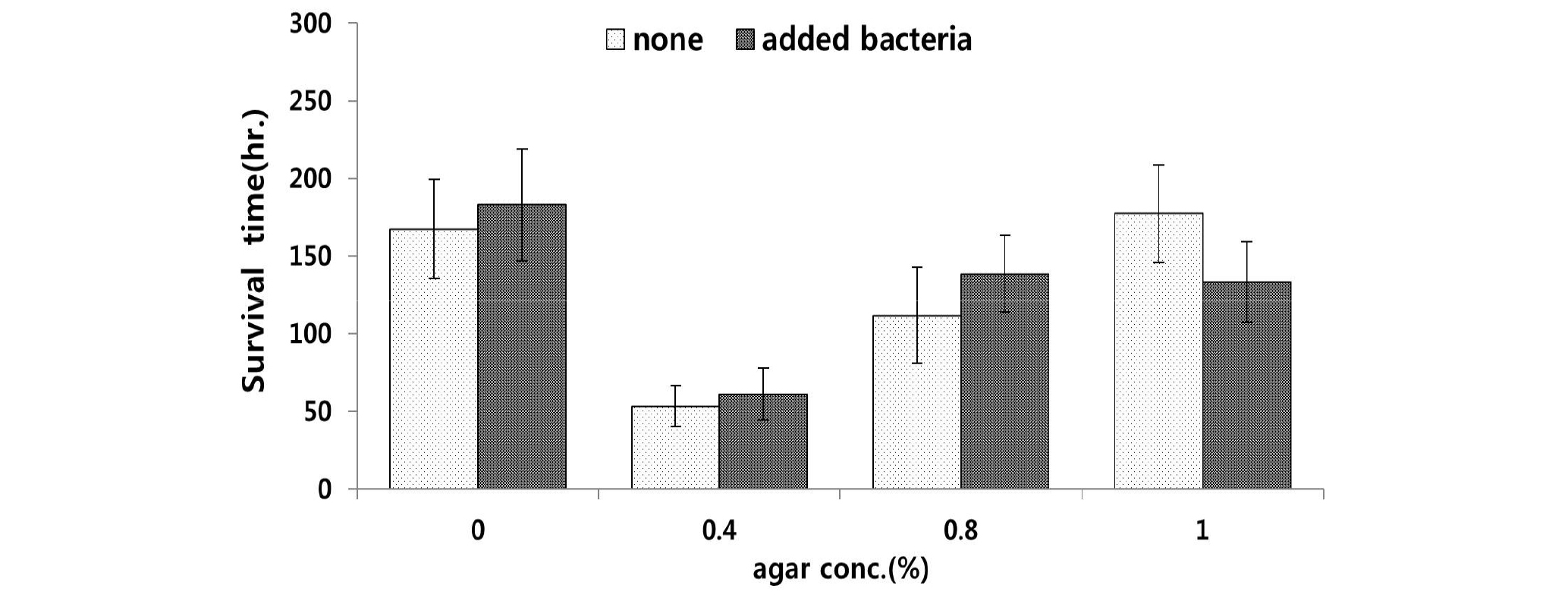
평균 생존시간이 가장 높았던 배지는 먹이원인 박테리아를 공급해준 한천농도 0%의 배지였으며 생존시간은 평균 183시간으로 나타났고, 평균 생존시간이 가장 낮은 농도는 박테리아를 공급하지 않은 한천농도 0.4%였으며, 생존시간은 평균 61.2시간으로 나타났다(Fig. 5). 실험 4의 선충류의 생존시간은 한천 농도에 따라 유의한 차이를 보였으며(P<0.05), 박테리아 공급 유무에 대해서는 유의한 차이를 나타내지 않았다(P>0.05).
기존 수행되었던 연구 중, 배지 제작 시에 bacto peptone과 소고기 육즙을 동시에 첨가하여 선충류를 배양한 연구는 있지만(Moens et al., 2005a), 그 두 종류의 영양성분 중 어떠한 성분이 선충류의 생존을 더욱 유리하게 만드는지에 대한 연구 결과는 없다. 따라서 본 연구에서는 첨가한 영양성분인 bacto peptone과 소고기 육즙이 각각 선충류의 생존시간에 미치는 영향을 알아보기 위하여 실험 5와 6을 진행하였다.
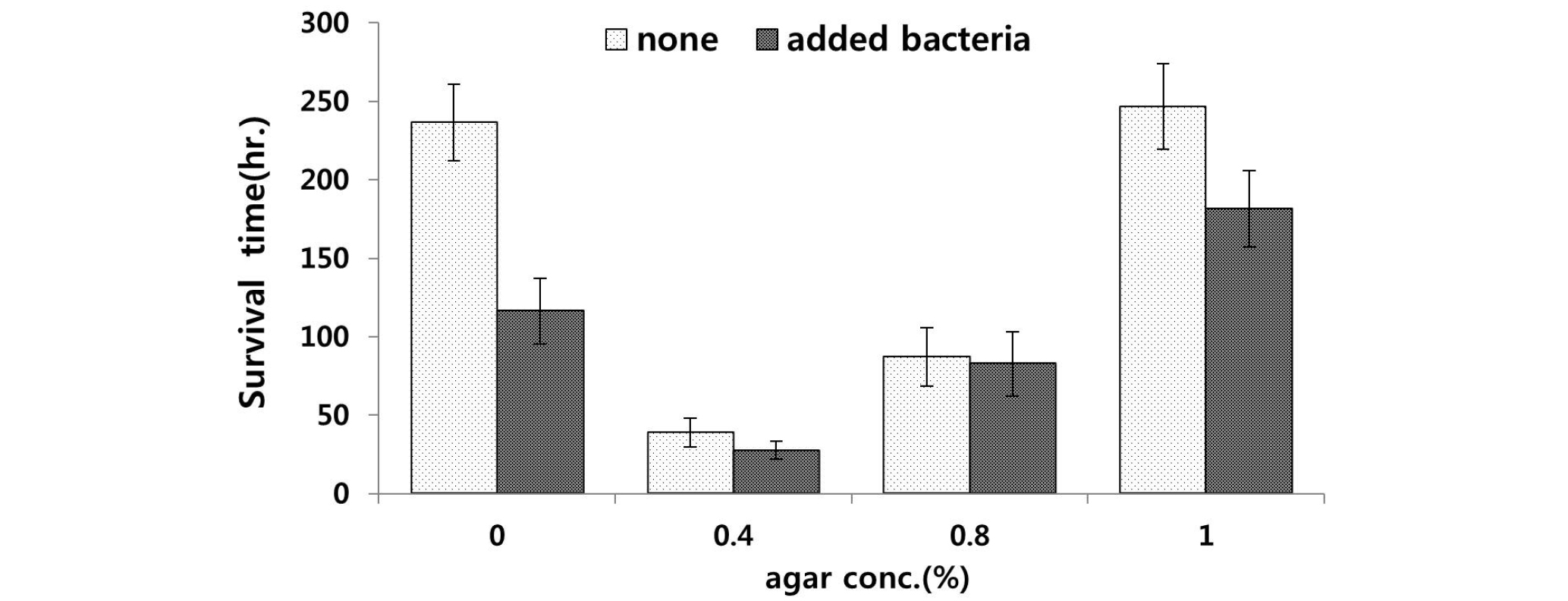
실험 5에서는 소고기 육즙만을 첨가하여 제작한 배지로 한천농도 0, 0.4, 0.8, 1.0%의 배지에 20°C, 암배양으로 실험을 수행하였다. 먹이 공급을 하지 않은 한천농도 1.0%의 배지에서 평균 246.8시간으로 가장 높은 생존 시간을 보였고, 그다음으로는 먹이 공급을 하지 않은 한천 농도 0%의 배지에서 평균 236.6시간으로 높은 생존시간을 나타냈다. 한천농도 0.4%의 먹이 공급을 한 배지에서 평균 27.6으로 가장 낮은 생존시간을 나타냈다(Fig. 6).
각 농도의 배지 중에서 먹이 공급을 한 배지에 비하여 먹이 공급을 하지 않은 배지에서 높은 생존시간을 나타냈고, 선충류의 생존시간은 배지의 한천 농도에서 유의한 차이를 보였으며(P<0.05), 먹이 공급 유무에 대해서도 유의한 차이를 나타냈다(P<0.05). 소고기 육즙을 첨가한 실험 5의 한천농도 1.0%의 배지에 박테리아를 공급하지 않은 배지에서 전체 실험 중 가장 높은 평균 생존시간을 나타냈다.
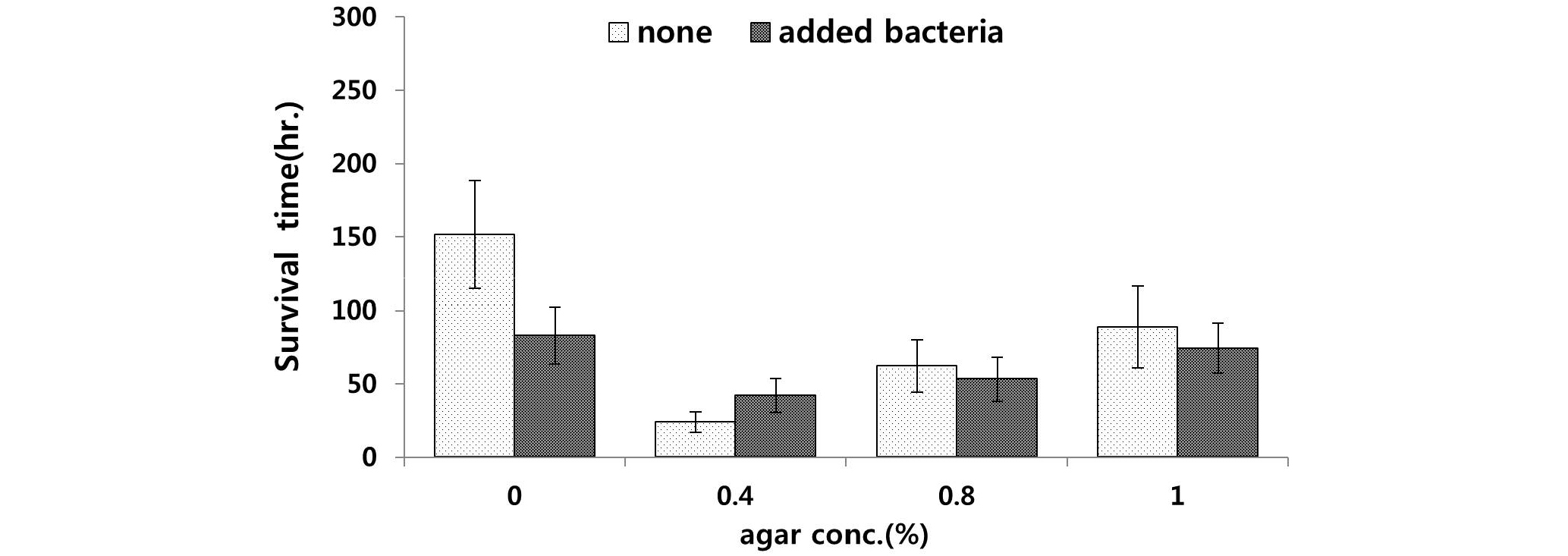
실험 6에서는 실험 5와 동일한 조건에, bacto peptone만을 첨가하여 실험을 진행하였다. 그 결과, 가장 높은 평균 생존시간을 보인 배지는 먹이 공급의 유무와 상관없이 한천농도 0%였으며, 가장 낮은 평균 생존시간은 먹이 공급이 없었던 한천농도 0.4% 배지로 나타났다(Fig. 7).
가장 높은 생존시간은 먹이 공급이 없었던 0%의 배지에서 평균 151.4시간으로, 가장 낮은 생존시간은 평균 42시간으로 나타나, 실험 5에 비하여 평균 생존시간이 낮은 경향을 보였다. 실험 5와 실험 6의 결과를 보면, 실험 4에서 해양선충류의 평균 생존시간 증가에 영향을 미치는 요소는 bacto peptone보다 소고기 육즙이라고 생각되어진다.
실험 1~3의 실험 결과를 보면 대부분 먹이원으로 박테리아가 공급된 배지에서 선충류의 생존시간이 짧은 경향을 나타내었다(Figs. 2, 3, 4). 이를 보완하기 위해 한천배지에 선충류의 먹이원으로 공급하였던 박테리아를 대체할 수 있는 영양성분을 추가하였고, 그 영양성분인 소고기 육즙과 bacto peptone의 추가로 인한 선충류의 생존시간의 차이를 확인하기 위하여 수행한 실험 4~6에서도 박테리아를 공급하지 않은 배지에 비하여 박테리아를 공급한 배지에서 선충류의 생존시간이 낮은 경향을 나타내었다(Figs. 5, 6, 7). Moens and Vincx (1998)의 연구 결과를 보면 선충류의 종에 따라서, 적합한 배지의 한천 농도, 첨가하는 영양성분, 박테리아나 조류의 공급 유무 등이 달라진다는 것을 알 수 있는데, Enoplolaimus sp.의 경우에는 소고기 육즙을 첨가하여 제작한 한천농도 1.0%의 배지에 박테리아를 공급하지 않은 조건이 생존에 가장 적합하다고 생각된다.
향후 국내 서식하는 선충류의 발생 또는 생활사 연구, 생리 실험 등에 활용할 수 있도록 우리나라에 서식하는 각 해양선충류의 종에 따른 적합한 배양 조건에 대해, 다양한 연구가 필요할 것으로 사료된다. 실험 1~6의 결과, 대부분 먹이 공급을 하지 않은 배지에서의 생존시간이 더 높은 결과를 나타냈는데, 자연상태와는 달리 실험실 내에서 Enoplolaimus sp.를 배양하기 위해서는 박테리아의 공급을 하지 않는 것이 생존시간을 늘리는 데 적합한 조건이라고 보여진다.
실험 1~6 각 실험 조건들에 따른 선충류의 생존 시간은 유의한 차이를 보였다(P<0.05). Mesel et al. (2003)의 연구에서 Panagrolaimus paetzoldi 는 박테리아의 증식을 억제했음에도 불구하고 매우 높은 서식밀도를 보였는데, 이는 박테리아의 공급을 하지 않은 배지에서 더 높은 생존시간을 나타낸 본 연구 결과와도 유사하며, 실험실 내에서 선충류를 배양할 때에, 종에 따른 박테리아의 공급 전략이 선충류의 생존시간과 밀접한 관계가 있다고 여길 수 있는 결과라고 보여진다.
또한 기존 수행된 해양선충류 배양 연구 결과들에서 선충류의 섭식 유형 중, 비선택적퇴적물식자(non-selective deposit feeder) 형태를 갖는 종을 대상으로 한 연구가 비교적 많이 진행되었다. 다양한 배양 기질 중에서는 bacto agar와 nutrient agar가 혼합된 한천배지가 주로 배양에 이용되었으며, 대부분 박테리아를 먹이원으로 공급하였다. 한천의 농도와 선충류에 제공되는 영양 성분은 각 대상종별로 다양하게 사용되었다(Table 2). 기존 연구에서의 배양 종들과 본 연구에서 배양한 대상종인 Enoplolaimus sp.과 섭식 유형, 서식 환경, 크기 등에서 차이가 있으므로 배지의 조성과 조건에 대한 직접적인 비교는 어렵다. 그러나 기존 수행되었던 연구의 조건들은, 향후 국내 서식하는 여러 해양선충류에 대하여 배양 실험을 수행할 때 생존 적합 배지 제작에 매우 중요한 참고 자료로써 이용 가능하다고 생각된다.
Table 2. Conditions of previous culture studies on marine free-living nematodes (*= no data).
3.2 Bathylaimus sp.의 생존 적합배지 선정
산란과 발생 및 부화 관찰 실험에 앞서, 포란 확인이 용이한 Bathylaimus sp.의 암컷을 대상으로 생존 적합배지 선정을 위한 실험을 진행하였다(Fig. 8).
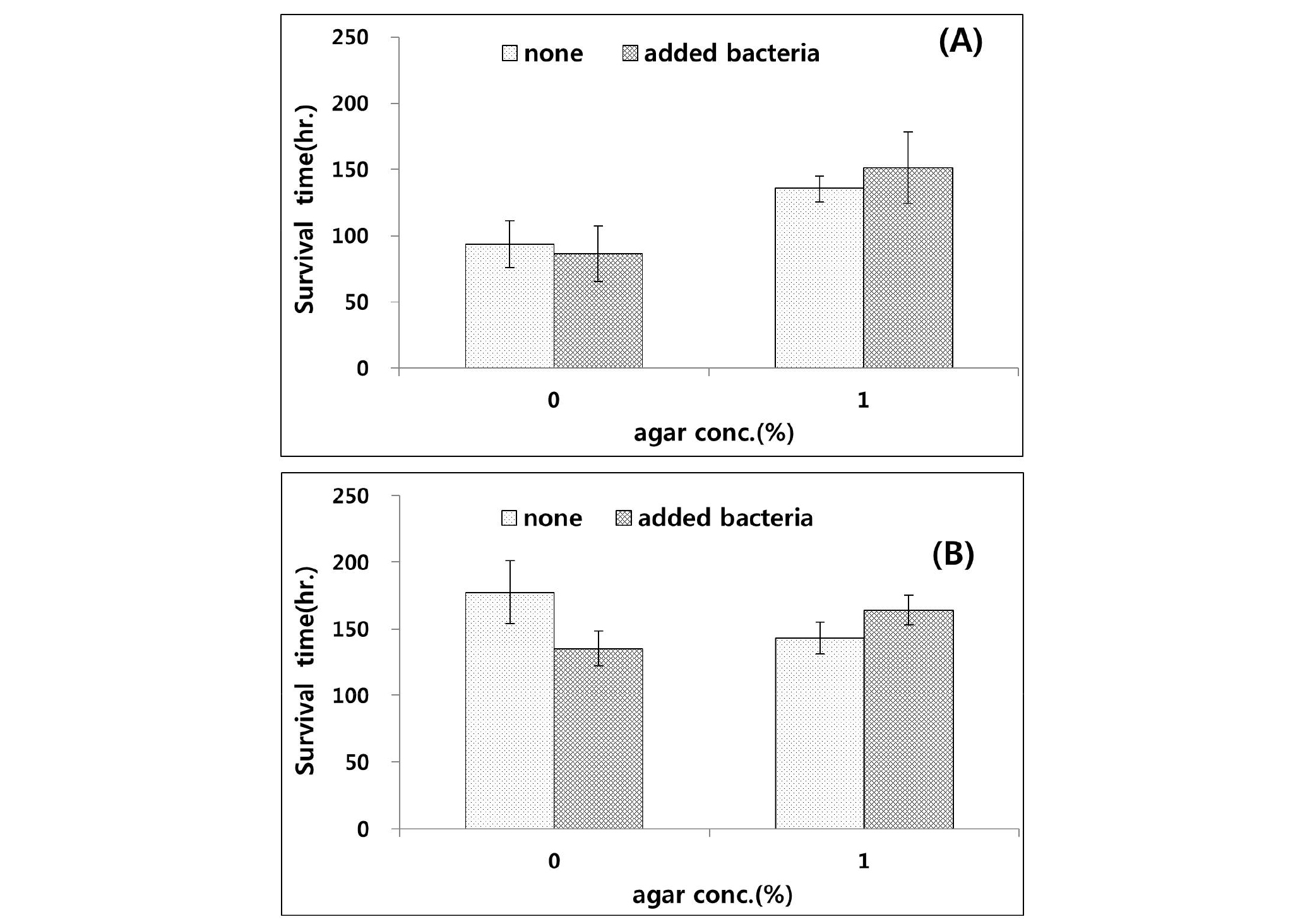
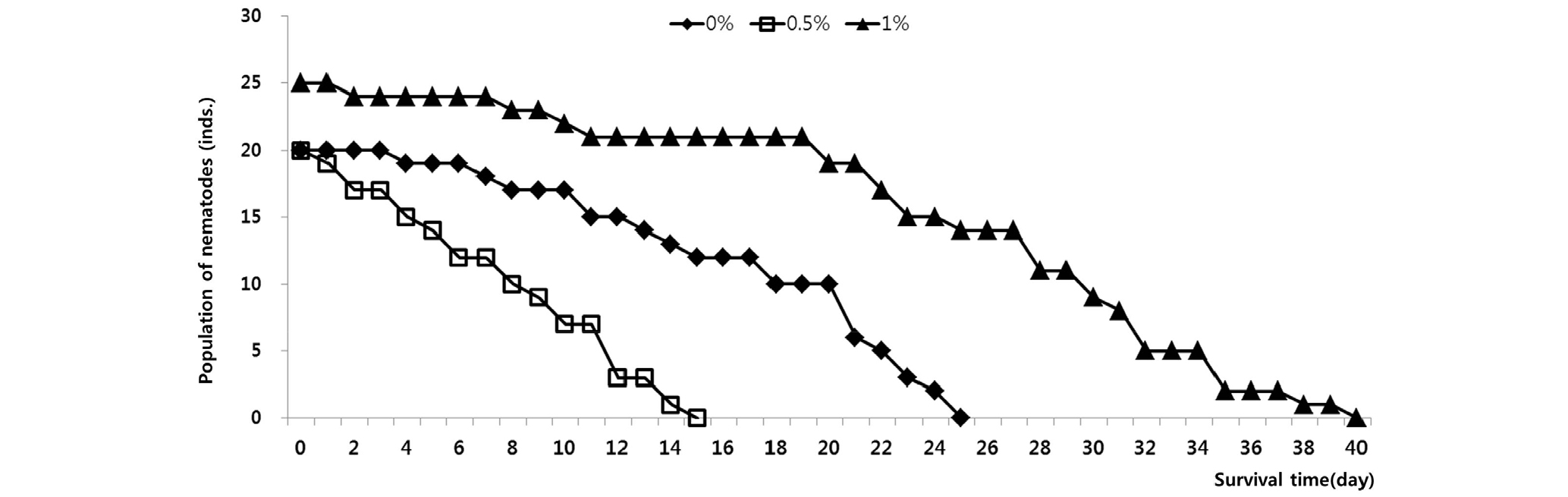
산란과 발생 및 부화 실험을 하기에 앞서, Bathylaimus sp.가 서식하기에 적합한 조건을 알아보기 위하여 실험 7과 8을 진행하였다. 실험 7과 8의 결과에서는 한천농도 1.0%의 한천 배지에서 생존율에 가장 유리한 결과를 보였고 한천농도 0.5%의 한천 배지에서 가장 낮은 생존율을 나타냈으며(Fig. 9), 한천 농도에 따른 선충류의 생존시간이 유의한 차이를 보이는 것을 확인하였다(P<0.05).
3.3 Bathylaimus sp.의 산란 및 부화 배양 실험
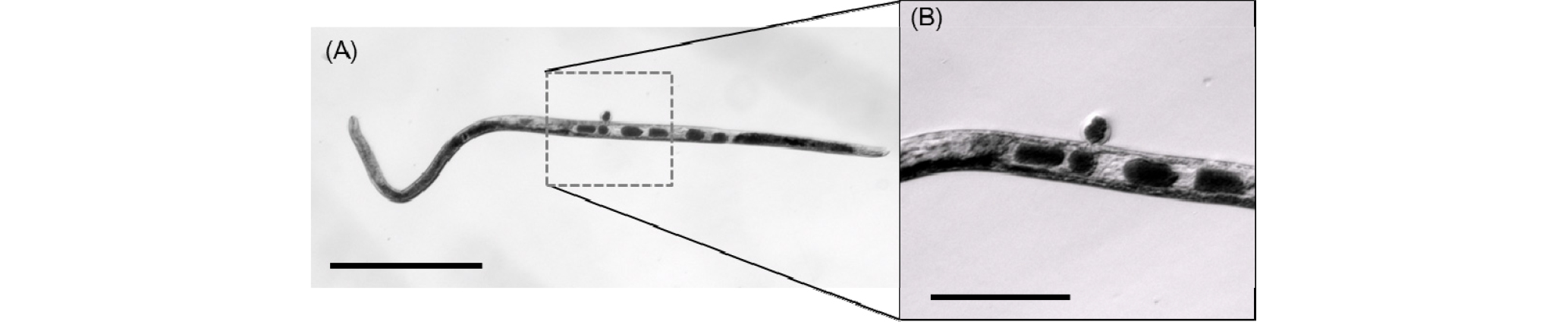
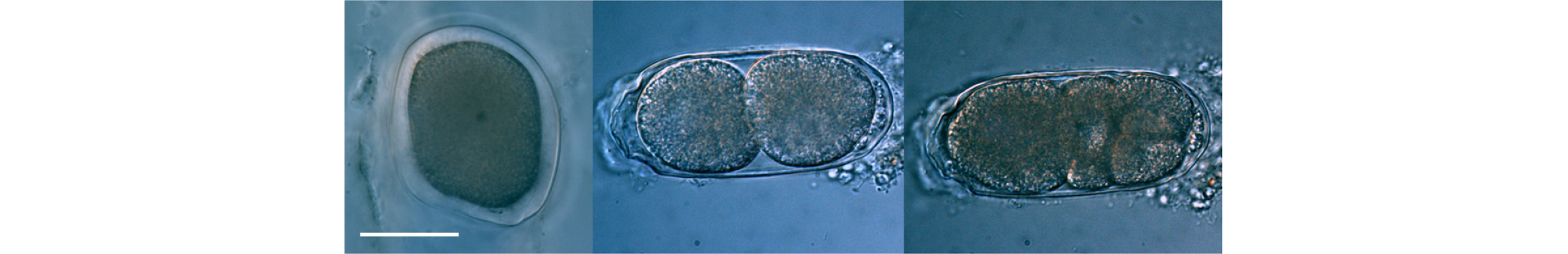
실험 9에서는 알을 가지고 있는 암컷만을 추출하여(Fig. 10) Bathylaimus sp.의 평균 산란량과 산란 후 부화까지의 평균 시간 및 부화율을 확인하고자 하였다. 알을 가지고 있는 암컷을 각 1개체씩 한천농도 1.0%의 Killian 배지에 접종하고, 반복수 16으로 실험한 결과, 산란한 알의 개수는 4~10개로 평균 7개의 알을 산란하였다(Fig. 11). 산란 후 평균 3 시간에 2세포기, 평균 6시간에 3혹은 4세포기로 되고(Fig. 12), 평균 12시간 후에는 포배기(blastula stage), 평균 36시간에 낭배기(gastrula stage) 혹은 콩 모양의 형태(bean stage)로 되었다. 발생이 진행된 난은 평균 72시간에 자충의 형태까지 성장하고, 82~106시간이 지나고 부화하였으며 평균 부화 시간은 99.5시간이었다(Fig. 13, Table 3). 부화율은 94.7%로 나타났다. 부화하지 않은 알은 산란 직후에는 분별하기 어려우나 12시간이 지난 후에는 발달하지 않고 있는 것을 관찰할 수 있었고, 점차 박테리아에 의하여 분해되어 82시간 이내로 완전히 분해되어 소멸하는 것을 관찰할 수 있었다. 또한 한 개체에서 산란된 알이라고 할지라도 부화까지의 시간은 최대 24시간이 차이가 났고 부화한 선충류 유생은 한천 농도 1.0%의 배지에서 활발히 움직여 부화된 장소에서 넓게 퍼지며 이동하는 행동이 관찰되었다. Daptonema normandicum 암컷의 경우 일반적으로 8~10개(Singh and Ingole, 2011), Chromadora macrolaimoides 는 10~12개(Tietjen and Lee, 1973), Prochromadorella sp.와 Spiliphera sp. 은 14~19개(Mutsumi et al., 1998), M. denticulata 는 18~23개(Tietjen and Lee, 1972)의 알을 산란하는 것에 비하여 본 연구의 대상종인 Bathylaimus sp.의 경우 상대적으로 산란하는 알의 개수가 적은 것으로 나타났다. 또한 배아 발달에 걸리는 시간은 M. pareleqantula 이 48시간, D. normandicum의 경우 78시간으로(Vranken et al., 1981) 평균 99.5시간인 Bathylaimus sp.가 배아 발달에 걸리는 시간이 상대적으로 긴 결과를 나타냈다.
Table 3. Result of spawn and embryonic development experiment of Bathylimus sp.
선충류는 종에 따라 적합한 배양 기질과 조건이 다르지만(Moens and Vincx, 1998), 선충류의 종과 관계없이 알의 산란 및 부화에는 고체 한천 기질이 상대적으로 더 높은 산란량과 낮은 폐사율을 보인다고 알려져 있다(Vraken et al., 1981). 따라서 고체 배지에서의 부화 이후, 부화된 선충류 유생들을 대상 선충류의 종에 따른 적합한 기질과 조건의 배지로 옮겨 성체까지 배양함이 바람직하다. 또한, 선충류는 산소 결핍에 대한 내성 범위가 넓은 것으로 알려져 있다(Taheri et al., 2014). 하지만 알의 산란과 성숙, 생식을 위해서는 적정 산소 농도가 필요하다는 연구 결과(Jensen, 1995; Boufahja et al., 2016)에서 알려져 있듯이, 산소 결핍에 대한 내성이 생기는 성체가 되기 전까지는 배양 시 일정 주기로 배양 배지를 새 배지로 교체해주는 등, 산소 농도에 대한 주의가 필요하다고 생각된다. 본 연구의 경우 대상 선충류인 Bathylaimus sp.의 생존에 적합한 배지가 고체 한천 기질인 1.0% 배지였기 때문에 선충류의 알의 산란과 부화 및 그 이후 선충류 유생의 성장까지 동일한 조성의 배지로 실험이 가능할 것이라고 생각된다. 또한 Moens et al. (2000a)의 연구 결과 중 염분도 35 psu의 조건에서 Pellioditis marina 는 성체의 사망률에서는 미미한 영향을 미치는 반면에, 성체가 되지 않은 개체에서는 90% 이상의 사망률을 유발하였고, 이와는 다르게 Diplolaimelloides meyli 는 염분도가 사망률에 영향을 미치지 않았는데, 이러한 결과로 미루어 보면, 선충류 종과 발달 단계에 따라 배지의 염분도가 선충류의 생존 시간에 영향을 미칠 수 있다고 사료되므로 국내 서식하는 선충류의 종에 따른 적정 염분도에 대한 연구도 차후에 이루어져야 한다고 생각된다.
현재까지 계대배양에 성공한 해양 선충류의 종류는 극히 적다(Tietjen et al., 1970; Gerlach and Schrage, 1971; Jensen, 1982). 특히 그동안 극소수이지만, 이전에 수행된 대부분의 실험은 뻘에서 서식하는 생물종이 대다수이었고, 모래에 서식하는 종에 대해서는 극히 일부분만 수행되었다(Gerlach and Scharge, 1971; Vranken and Heip, 1986; Tsujino, 1997). 특히 모래에서도 퇴적물 표면식자(Epistrate feeder)에 대해서만 이러한 일부 연구 결과물이 있을 뿐이고(Tsujino, 1997) 이번 연구결과의 대상종인 Enoplolaimus sp.와 Bathylaimus sp.처럼 잡식성(omnivores)인 경우는 처음이라 그 의미가 더욱 크다고 할 수 있겠다. 특히 우리나라 주변 해역에서 선충류의 배양과 그로 인한 생활사 초기 연구는 본 연구가 처음이라는 점에서 향후 여러 연구에 잘 활용될 것으로 기대된다.
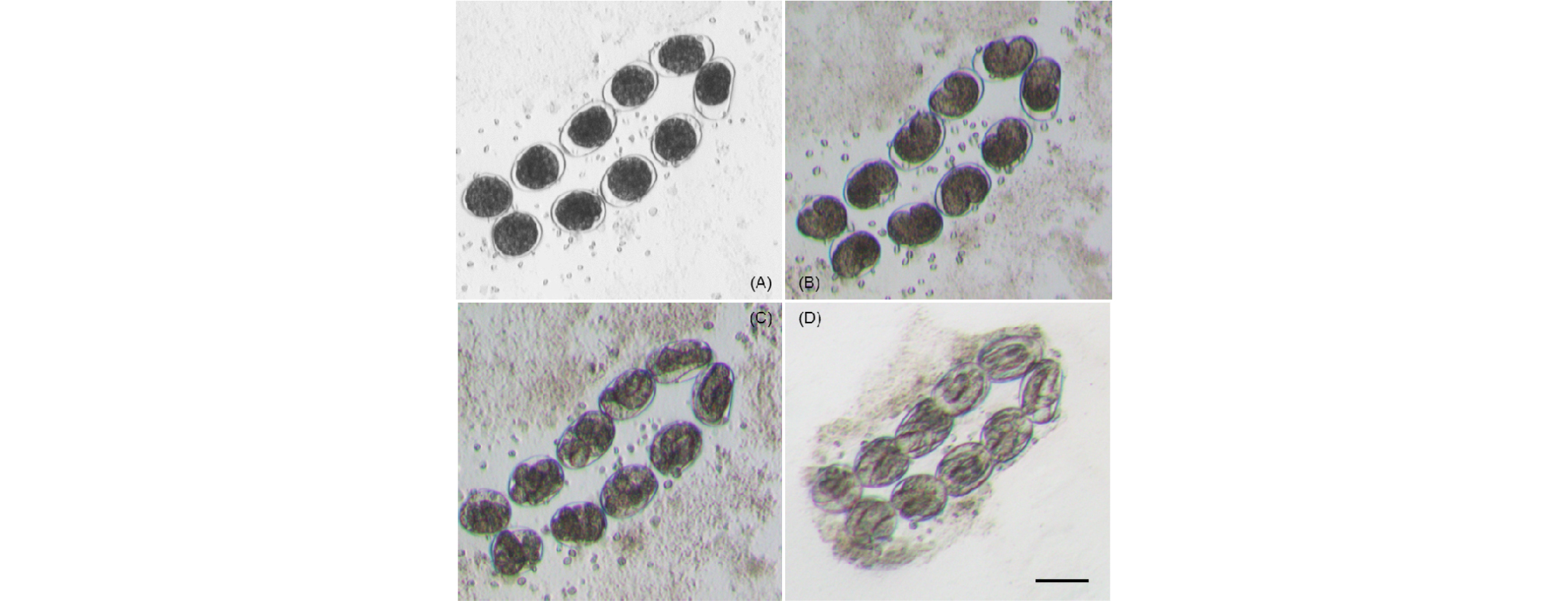
향후 1) 한천배지를 이용하여 부화된 선충류의 유생(Fig. 14)이 성체까지 성장하고, 배지 내에서 재생산되는 실험을 진행하여 Bathylaimus sp.의 생활사에 대한 연구를 심도 있게 할 예정이며, 2) 앞서 했던 여러 배양실험은 종에 따라 활용하고 발전시켜 국내 서식하는 해양선충류의 각 종들을 단일종으로 대량생산할 수 있는 적합배지를 찾는 기초자료로써 이용할 수 있다고 생각되어진다. 이렇게 배양된 단일종의 해양선충류는 국내 조간대 및 조하대 저서생태계에 영향을 미치는 다양한 물질들에 대한 실험실 내 생리 ‧ 생태 실험에 활용할 수 있을 것으로 기대된다.