1. 서 론
2. 재료 및 방법
2.1 연구지역
2.2 조사방법
2.3 유기물 분석방법
3. 결과 및 고찰
3.1 해양환경 주요 인자들의 분포특성
3.2 COD의 시공간적 분포특성
3.3 TOC (DOC+POC)의 시공간적 분포특성
3.4 이론적산소요구량(TOD)을 이용한 COD 산화효율성 추정
4. 결 론
1. 서 론
해수 중 유기물은 다양한 기원에 의해 공급되고 복잡한 반응성을 가지고 있으며, 해양에서 오염원으로 작용할 뿐만 아니라 탄소순환 과정에서 중요한 역할을 한다(Hayase and Shinozuka, 1995). 또한 육상으로부터 유입된 다량의 영양염은 식물플랑크톤을 대량 번식시키며, 이들의 사체는 침강하여 저층에 유기물의 축적 또는 분해되는 과정에서 다량의 산소를 소모시킨다(Broecker, 1974). 유기물은 박테리아, 원생동물 등 먹이활동 중에 해양 먹이망을 통해 전달되며, 이 생물들이 죽으면 조직이 분해되어 용존 유기물(Dissolved organic matter; DOM)을 해수 중으로 방출한다. 또한 해양생물의 사체나 육상으로부터 유입된 미세한 생물조각에서 유래된 유기입자(detritus)들이 입자성 유기물질(Particulate organic matter; POM)로 존재한다(Libes, 2009).
해수 중 유기물은 분해 특성에 따라 생분해성 유기물과 난분해성 유기물로 구분된다. 생분해성 유기물은 미생물에 의해 쉽게 분해되며, 분해속도가 빨라서 다량의 산소가 소모되어(Ogura, 1975), 저층에서 산소가 결핍된다(Soetaert et al., 2006; Diaz and Rosenburg, 2008). 난분해성 유기물은 미생물에 의해 분해가 어려운 이중결합 또는 방향족 구조로 이루어져 있어 수중에 오랫동안 존재한다(Hur et al., 2006). 수중의 유기물 농도를 분석하는 방법은 생물학적산소요구량(Biological Oxygen Demand; BOD), 화학적산소요구량(Chemical Oxygen Demand; COD), 총유기탄소(Total Organic Carbon; TOC) 등이 있으며, 미국, 일본, 독일, 스위스 등에서는 수중의 유기물량을 측정하는 기준으로 BOD, COD, TOC를 병행하여 사용하고 있다(Jung et al., 2016).
국내에서는 최근 들어 폐수 및 하수 중 분해 가능한 유기물 처리 효율이 높아지면서, 난분해성 유기물의 부하가 상대적으로 증가하여 COD로 측정할 수 없는 유기물에 대한 문제점이 부각되고 있다(Choi and Han, 2006). 우리나라는 2013년부터 환경정책기본법에서 공공수역(하천, 호소)의 생활환경 기준에 TOC 기준을 설정하여 수생태계를 관리하고 있다. 또한 2020년 1월 1일부터 물환경보전법에서 신규로 설치되는 공공폐수처리시설의 방류수 수질기준, 폐수배출시설의 배출허용기준이 COD에서 TOC로 유기물 측정 지표가 전환되면서 TOC 적용범위를 확대하고 있다.
반면 해역은 2011년에 생활환경 기준 항목 중 유기물(COD)에 대한 기준을 삭제하고, 부영양화 지수 항목(용존무기질소, 용존무기인, 클로로필 a, 투명도, 저층산소포화도)에 대한 기준으로 전부 개정하여 현재는 해양에서 유기물 항목 기준이 부재한 상태이다. 그럼에도 불구하고 해양환경 정책의 이행평가와 해역이용영향평가 등에서 해양의 수질을 평가할 때, COD를 유기물 오염 지표 항목으로 이용하고 있는 실정이다. 따라서 해양환경에서 유기물 지표에 대한 기준 재검토 및 보완이 필요하고, 육상에서 해양으로 유입되는 오염물질 배출수의 유기물 측정 지표 변화에 대응하기 위해서 해수 중 COD와 TOC의 비교 검토는 불가피한 시점이다.
해양환경공정시험기준에 제시된 COD 분석법은 알카리성 과망간산칼륨법으로, 유기물을 산화시키고 소모된 산화제의 양으로 부터 유기물 양을 추정한다(MOF, 2018a). 유기물 뿐만 아니라 황화수소, 암모니아 등 환원된 무기물을 산화할 때도 산소가 소비되기 때문에 분석법에 한계가 있다고 보고되었다(Son et al., 2003). 해수 중 TOC 분석은 유기물을 금속촉매를 이용한 고온연소장치로 완전히 산화시킨 후, 발생되는 이산화탄소를 비분산형 적외선 감지기로 측정한다. 고온산화방식의 TOC 분석법은 비교적 산화율이 높고 분석자료에 대한 정확성 및 재현성이 좋다고 알려져 있다(Jung et al., 2016).
연구해역인 마산만은 1970년대 이후 형성된 대규모 자유무역단지 및 산업단지 조성으로 인해 오염이 심화되기 시작하였고, 1981년 남해안에서 최초로 유해성 적조가 발생하여 수산피해가 나타났다. 이 문제를 해결하기 위해 마산만을 포함한 진해만 일원을 1982년 특별관리해역으로 지정하였고, 2007년 연안오염총량관리제도를 도입하여 육상으로부터 유입되는 오염물질의 부하량을 5년 단위로 관리하고 있다. 관리대상 물질 및 목표 수질농도는 1차에 COD (2.5 mg L-1), 2차에 COD (2.2 mg L-1), TP (0.041 mg L-1), 3차에는 COD (2.1 mg L-1), TP (0.032 mg L-1)였다(MOF, 2018b). 2007년부터 유기물 관리 지표로 이용되고 있는 COD는 분석 시 해양에 존재하는 난분해성 물질 또는 염분 등의 간섭을 받기 때문에 유기물 함량을 정량적으로 해석하기에 다소 무리가 있다(MOF, 2018a).
따라서 본 연구에서는 2015년 마산만 내 COD와 TOC 농도의 시공간적 분포특성을 파악하고, 현재까지 오염지표로 사용하고 있는 COD의 산화효율성을 산정하여 유기물 지표로서의 적절성을 검토하고자 한다.
2. 재료 및 방법
2.1 연구지역
마산만은 100만명 이상의 인구가 밀집한 경상남도 창원시에 둘러싸여 있는 우리나라의 대표적인 반폐쇄성 내만이다. 마산만이 위치해 있는 도시의 총 유역 면적은 734.6 km2이며, 마산만의 표면적은 약 71 km2이고, 만 내부는 좁고 긴 수로로 연결되어 있다(Chang et al., 2012). 만의 수심은 5~25 m(평균 15 m)이며, 부피는 약 0.77 km3이다. 또한 크고 작은 하천들을 통하여 여름에 약 713,000 m3 day-1의 담수가 만으로 유입되고 있다. 내만은 조류의 영향이 적어 외해수와 해수 교환율이 약 14%에 불과하다(Yoo and Kim, 2019). 마산만의 대조차는 1.9 m, 소조차는 1.7 m, 평균 해면의 조위는 약 1.1 m, 최고 만조위는 약 2.2 m이다(KHOA, 2016).
2.2 조사방법
2015년 마산만 표층 및 저층의 수온, 염분, 용존산소(DO), 클로로필 a (Chl a), COD와 TOC(용존유기탄소(DOC: Dissolved Organic Carbon)+입자유기탄소(POC: Particulate Organic Carbon))의 시공간적 분포특성을 조사하였다. 현장조사는 2월, 4월, 5월, 6월, 7월, 8월, 9월, 11월에 실시하였으며, 오염물질의 부하량이 증가하는 6월, 7월, 8월은 월 2회씩 조사하였다. 조사정점은 마산항 중앙부에서 가덕도 서방까지 약 30 km의 거리에서 13개 정점을 선정하여 현장조사를 실시하였다(Fig. 1).
수온과 염분은 현장에서 CTD (Seabird 19plus, Sea-Bird electronics Inc., USA)로 관측하였다(initial accuracy: conductivity 0.005 S m-1, temperature 0.005℃). DO는 시료 병에 기포가 발생하지 않도록 tube를 이용하여 해수를 천천히 DO 병에 옮겨 담은 후 3M의 염화망간과 알칼리 요오드화나트륨용액으로 산소를 고정한 후 윙클러-아지드화나트륨 적정법으로 현장에서 분석하였다. 클로로필 a는 90% 아세톤으로 추출 후 형광분광광도계(Turner Designs, 10-AU-005-CE, USA)로 측정하였다.
2.3 유기물 분석방법
유기물 분포특성을 파악하기 위해 COD와 POC, DOC 시료는 현장에서 전처리한 후 냉동보관하여 실험실로 옮겨 분석하였다. COD는 시료를 알카리성으로 하여 산화제인 과망간산칼륨으로 산화반응 시킨 후(60분간, 100℃ 중탕) 소비되는 과망간산칼륨의 양으로부터 산소량을 계산하여 추정하였다. TOC 농도는 DOC와 POC 농도의 합으로 계산하였다. DOC 분석용 시료는 해수 1,000 mL를 미리 전처리한 GF/F 여과지(직경 47 mm)로 여과하였다. 여과된 해수 약 100 mL는 DOC 분석용 시료로, 걸러진 여과지는 POC 분석용 시료로 이용하였다. 탄소 분석을 위해 제반된 모든 초자기구, 여과지는 세척 후 450~500℃ 회화로에서 24시간 이상 회화시킨 후 사용하였다. DOC 시료는 –20℃에서 냉동시킨 후 실험실로 옮겨 TOC-5000A (TOC-L, Shimadzu Co., Japan)를 이용하여 측정하였다. 표준물질은 프탈산수소칼륨(KHC8H4O4)을 이용하였고, 정확도와 정밀도는 각각 98~107%, 0.14~0.21%였다. POC는 무기탄소를 제거하기 위해 10N HCl로 훈증(acid fuming)하여 건조 후 tin capsule에 싼 다음 CHNs analyzer (Flash 2000, Thermo Scientific, USA)로 분석하였으며, 표준물질은 sulfanilamide (Merck, 1.04874.0250)를 사용하였다. POC 농도의 정확도 검증을 위해 이용한 인증표준물질(Soil Reference Material NCS, PN 338 40026)의 회수율은 93~108% 였다. 모든 분석은 해양환경공정시험기준(2018)을 준용하였으며, 자료분석을 위해 SPSS (ver. 21) 통계 프로그램을 사용하였다.
3. 결과 및 고찰
3.1 해양환경 주요 인자들의 분포특성
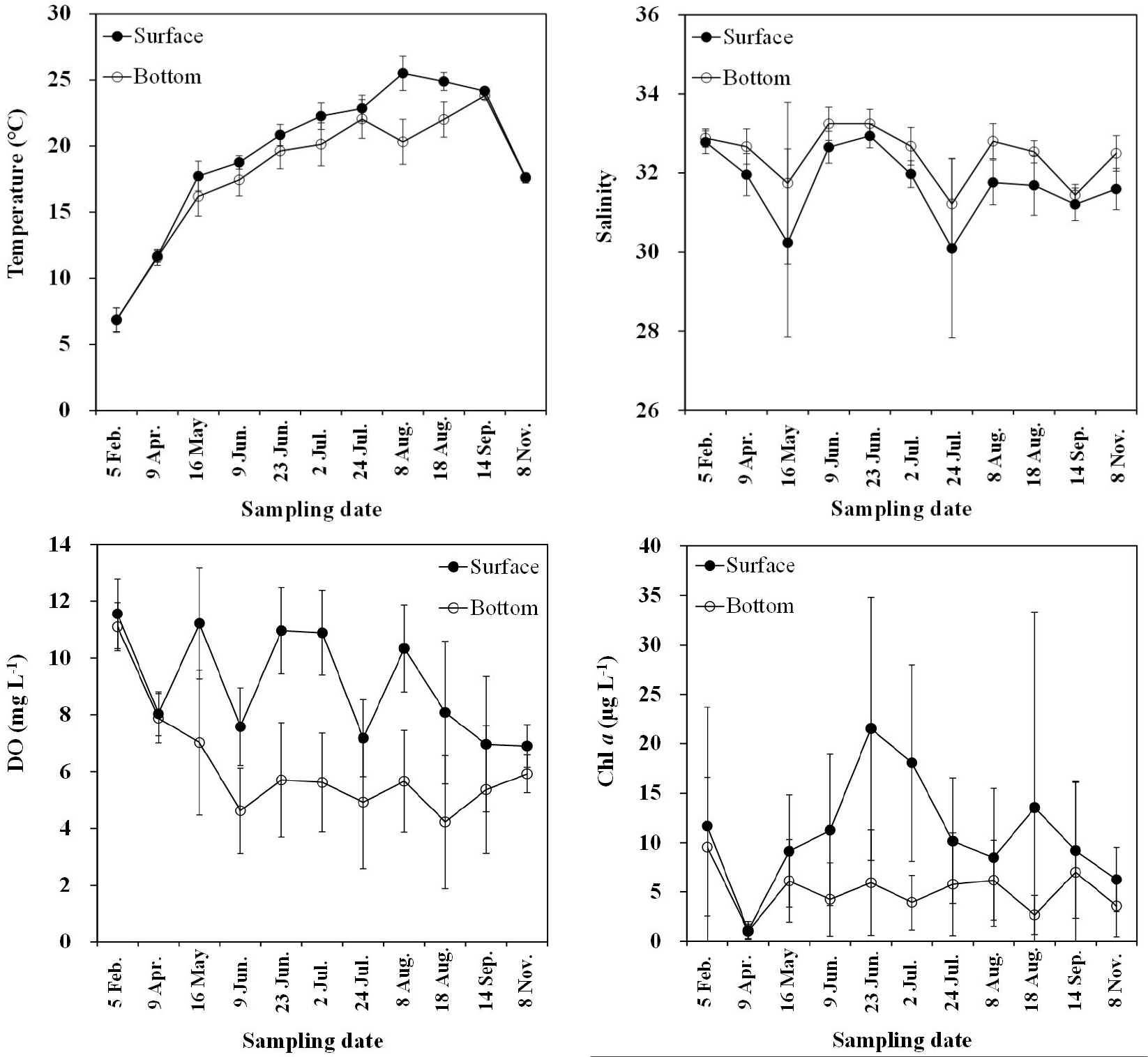
2015년 마산만 표층 수온은 6.07~27.77℃(연평균 19.38±5.60℃) 범위였고, 저층 수온은 6.18~24.34℃(연평균 17.97 ±4.90℃) 범위였다(Tables 1, 2, Fig. 2). 수온이 낮은 2월에는 정점 M3에서 최소 약 6℃, 정점 M11에서 최대 약 9℃로 동일시기에 정점 간 약 3℃ 차이를 보였고, 수온이 높은 8월에는 정점 M1에서 약 27℃, 정점 M11에서 23℃로 약 4℃ 차이가 나타났다. 전반적으로 겨울에는 내측에서 외측으로 갈수록 수온이 높아졌으나, 여름에는 내측에서 외측으로 갈수록 낮아지는 공간적 변화를 보였다. 수온은 기온과 해류 등 외부요인의 영향을 받으며(Cho and Lee, 2012), 연구기간 동안 마산만에서 기온과 수온의 상관성은 약 R2=0.90로 좋았다. 또한 만 내측은 겨울철에 낮은 수온의 담수유입, 여름철에 상대적으로 높은 수온의 담수유입(Lim et al., 2007)이 마산만 내·외측에서 수온의 계절적 공간 분포에 영향을 미친 것으로 판단된다.
Table 1.
Minimum, maximum, and average contents of temperature, salinity, DO, chlorophyll a, COD, TOC, DOC, and POC in surface seawater of Masan Bay during 2015
Table 2.
Minimum, maximum, and average contents of temperature, salinity, DO, chlorophyll a, COD, TOC, DOC, and POC in bottom seawater of Masan Bay during 2015
염분은 표층에서 23.61~33.36(연평균 31.72±1.37), 저층에서 27.40~34.11(연평균 32.45±1.01) 범위로 나타났다(Tables 1, 2, Fig. 2). 표층 염분은 5월 16일과 7월 24일에 평균 약 30으로 낮았으며, 표‧저층 염분 변동폭 또한 다른 시기에 비해 상대적으로 컸다(Fig. 2). 이는 다른 시기에 비해 집중된 강우에 의해 내만의 정점에서 담수유입으로 인한 영향이 컸던 것으로 파악된다(조사전 15일 동안 누적 강수량 각각 109 mm, 123 mm).
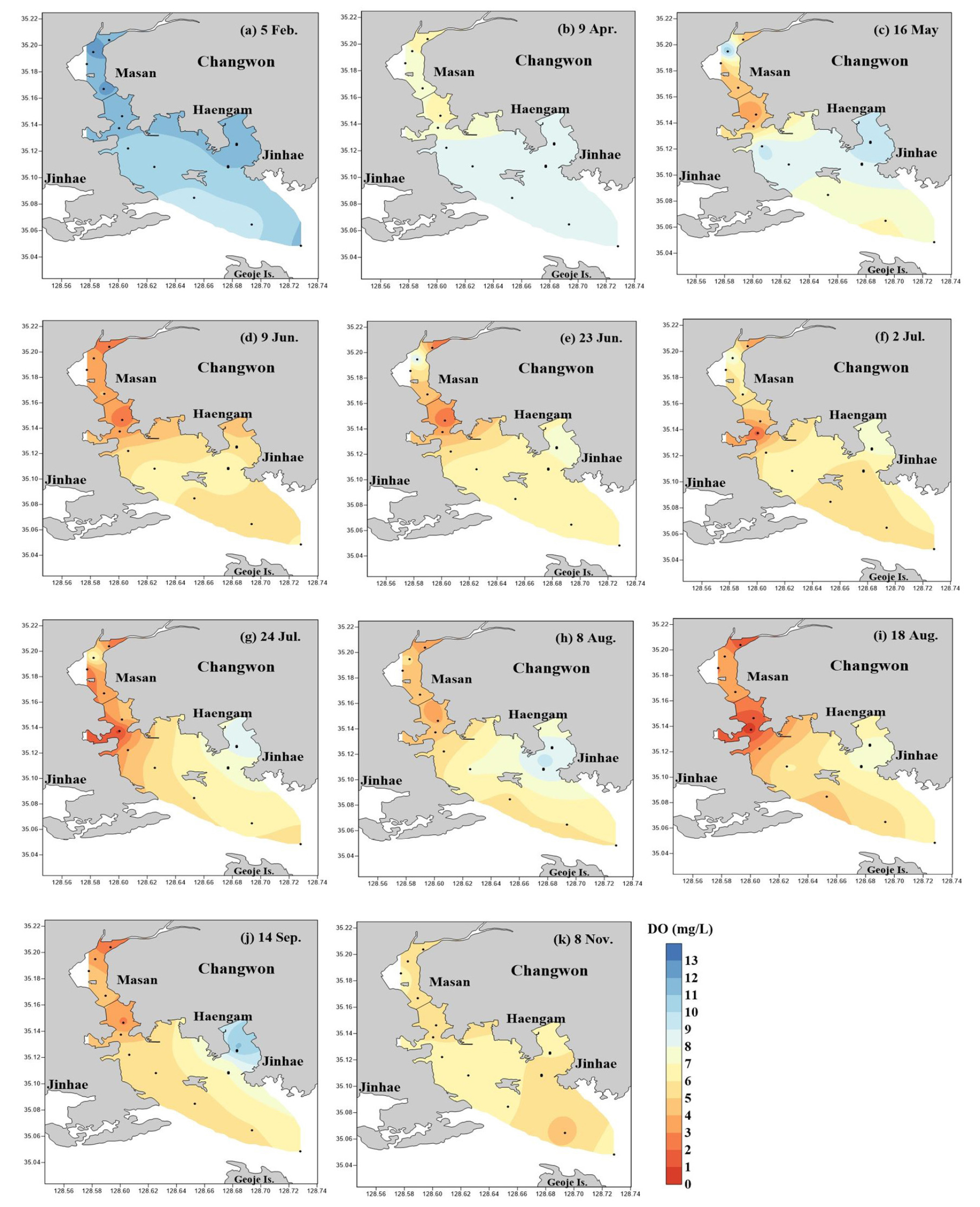
표층의 DO 농도는 3.65~16.27 mg L-1(평균 9.06±2.40 mg L-1), 저층은 0.52~12.42 mg L-1 (6.18±2.56 mg L-1) 범위로 표층에 비해 저층에서 상대적으로 낮게 나타났다(Tables 1, 2, Fig. 2). 특히, 5월부터 표‧저층간 DO 농도 차이가 컸으며, 8월까지 평균 2~5 mg L-1의 차이를 보였다(Fig. 2).
표층 수온이 평균 18℃ 이상으로 오르기 시작한 5월 16일부터 저층 DO 농도는 평균 7 mg L-1 이하로 떨어지기 시작했다(Fig. 2). 6월 9일에는 마산항 중앙부에서 모도 서방까지 약 9 km(정점 M1~M6)에서, 표층 수온이 평균 19℃ 이상으로 높을 때 저층 DO는 평균 3.19 mg L-1 이하로 낮았고(Fig. 3), 8월 18일에는 표층 평균 수온이 25℃로 높을 때 표‧저층의 DO 농도는 각각 6.03 mg L-1, 2.31 mg L-1로 저층에서 약 2.6배 낮았다(Figs. 2, 3). 마산항 중앙부에서 모도 서방까지 저층에서 DO 농도가 평균 3 mg L-1 이하 일때, 표‧저층 수온은 3℃ 이상 차를 보였고, 이때 강한 밀도약층이 형성되었음을 알 수 있었다(Figs. 2, 3).
일반적으로 DO 농도가 약 3 mg L-1 이하일 때를 빈산소수괴라고 정의한다(Tyson and Perason, 1991). 기후변화로 인한 표층 수온의 증가와 육상에서 인간이 만들어내는 영양염의 공급 때문에 전 세계적으로 해양에서 빈산소수괴의 발생해역이 증가하는 추세이다(Diaz and Rosenberg, 2008). 표층 수온의 증가는 수층의 성층화를 일으키고, 저층 DO의 순환을 차단시켜 빈산소수괴 형성을 가속화시킨다(Diaz and Rosenberg, 2008). 마산만 저층수 중 DO 농도는 주로 표층 수온의 영향을 받는다(Park et al., 2018). 또한 수온이 높은 여름에 해저퇴적물 내 유기물 분해로 인해 저층 해수 중 산소 소모가 증가하고 반폐쇄적인 만의 특성상 해수의 혼합이 활발히 이루어지지 않아서 저층의 DO 농도가 낮게 분포한 것으로 판단된다(Lim et al., 2007). 본 조사기간 동안 5월부터 표층의 수온 상승으로 인한 표‧저층의 밀도차는 수괴의 안정화를 유발시켜 표층에서 저층으로의 산소 공급을 차단하며, 유기물이 분해되는 과정에서 저층 DO 농도에 영향을 미친 것으로 판단된다(Lee and Lee, 1995; Glibert et al., 2005; Rabalais et al., 2009; Tishchenko et al., 2016).
마산만의 표층수 중 클로로필 a 농도는 0.33~76.00 μg L-1 (10.96±10.81 μg L-1) 범위였고, 4월 9일에 낮았고, 6월 23일에 높았다. 연중 만내측에서 외측으로 갈수록 농도가 낮아지는 것으로 보아 내측에서 식물플랑크톤의 대번식이 발생한 것으로 판단된다(Table 1, Fig. 2).
3.2 COD의 시공간적 분포특성
COD는 마산만 연안오염총량관리제도 시행 및 이행을 평가하는 척도로서 이용되고 있다. 5년 단위로 총량제 수질 목표를 설정하고 있으며, 1차 시행시(2007~2011년) COD 목표수질 값은 2.5 mg L-1, 2차(2012~2016년)는 2.2 mg L-1, 3차(2017~2021년)는 2.1 mg L-1로 설정하여 관리해 오고 있다. 2011년 하계(5, 8월) 표층의 COD 중앙값이 1.85 mg L-1로 1차 관리목표(2.5 mg L-1)를 달성했으며, 총량제 시행 전(2006년) 대비 2010년에 마산만으로 유입하는 총오염부하량이 약 29% 감소하였다(MOF, 2018b). 또한 2차 최종 년도인 2016년 하계 표층의 COD는 2.18 mg L-1로 관리목표를 달성했다(MOF, 2018b). Chang et al.(2012)과 Park et al.(2018)은 마산만의 주요 하천으로부터 만내로 유입되는 오염부하량은 연안오염총량관리제도 도입(2007년) 이후 점차 감소한 것으로 보고하였다.
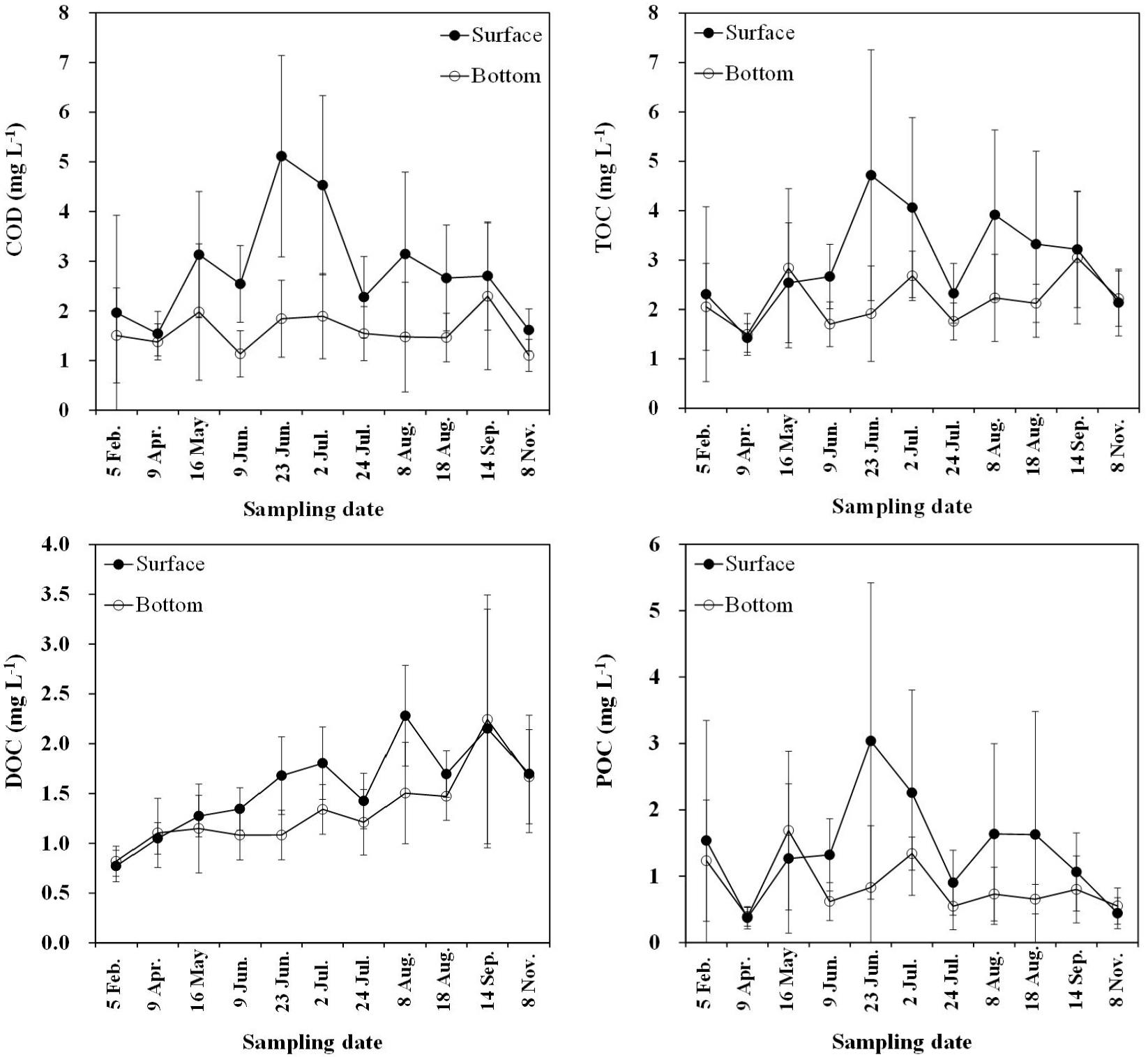
마산만에서 해수 중 유기물 지표로 사용되는 COD는 본 조사기간 동안 표층과 저층에서 각각 0.35~9.95 mg L-1 (2.85±1.67 mg L-1), 0.22~8.74 mg L-1 (1.65±1.09 mg L-1) 범위였다(Tables 1, 2). 표층의 COD는 2월, 4월, 11월에 평균 2 mg L-1 내외로 다른 시기에 비해 낮았고, 6월 23일과 7월 2일에 평균 농도가 4.5 mg L-1 이상으로 높았다(Table 1, Fig. 4). 특히 6월부터 8월까지 표층이 저층 보다 약 2배 이상 농도가 높다가, 9월, 11월, 2월, 4월에는 표‧저층의 농도가 유사했다(Fig. 4). 공간적으로 마산만 내측(정점 M1~M3)의 표층 COD 평균 농도가 4.01 mg L-1로 외측에 비해 약 2배 이상 높았다. 1997년부터 2016년까지 마산만 총량제 도입 전‧후 COD 농도는 전반적으로 감소했지만, 하계에 내측의 COD 농도는 오히려 높았다(Park et al., 2018). 하계 내측의 COD 농도 증가는 육상으로부터 유기물 공급, 만내의 자생 유기물 기원, 원활하지 않은 해수 유통 및 만내 체류시간의 증가 등이 영향을 미쳤을 것으로 보고된바 있다(Park et al., 2018).
3.3 TOC (DOC+POC)의 시공간적 분포특성
TOC (DOC+POC) 농도는 표‧저층에서 각각 0.50~12.08 mg L-1 (2.97±1.69 mg L-1), 0.92~7.43 mg L-1 (2.19±0.95 mg L-1) 범위였다(Tables 1, 2). 표층의 TOC 농도는 4월 9일에 평균 1.5 mg L-1 이하로 낮았고, 6월 23일과 7월 2일에 평균 4 mg L-1 이상으로 높았다(Table 1, Fig. 4). 6월부터 8월까지는 저층보다 표층에서 평균 농도가 약 1~2배 높았다. 반면 9월부터 표‧저층의 농도차가 감소하기 시작하면서 11월, 2월, 4월, 5월까지 표층보다 저층에서 농도가 약간 높거나 유사했다. 이러한 현상은 COD 농도와 유사한 분포 패턴을 보였다(Fig. 4). 유기물의 표·저층 농도차는 여름철에 형성된 성층화로 인해 물질 교환이 차단되어 COD, TOC 등에서 수직적 농도 차이가 발생한 것으로 판단된다(Cho et al., 1998). 이후 9월부터는 수괴의 안정화가 약해지고 표·저층 간 해수교환이 활발해 지면서 수층간의 유기물 농도가 유사하게 나타났다(Lim et al., 2007).
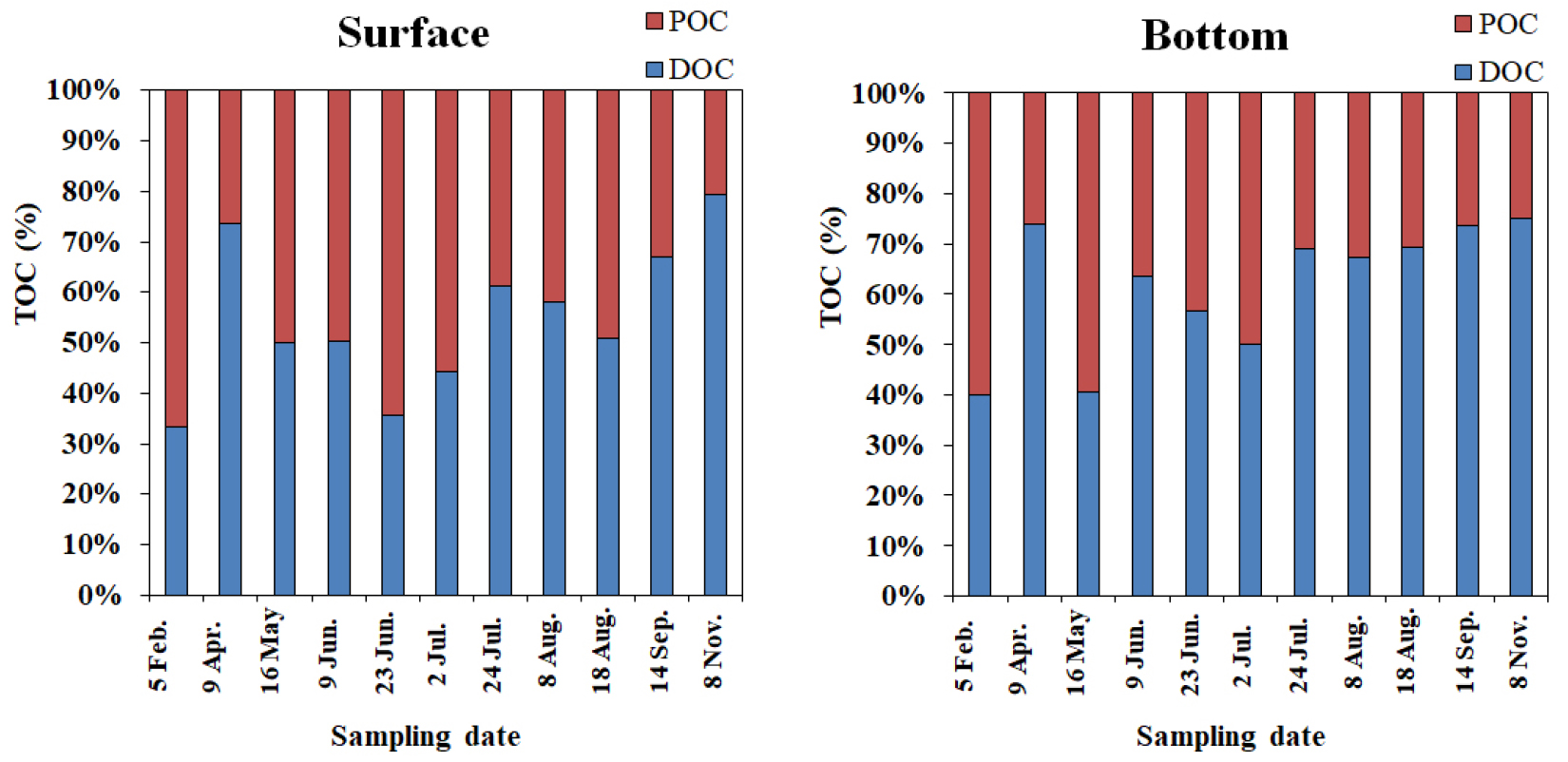
유기물의 함량을 지시해 주는 TOC 농도는 마산만 내측(정점 M1~M3)에서 연평균 4.18 mg L-1로 정점 M4~M13 (2.61 mg L-1)에 비해 약 1.6배 높았다. 조사기간 동안 TOC 중 DOC와 POC가 차지하는 비율은 각각 약 33~79%(평균 58%), 약 21~67%(평균 42%)로 DOC가 상대적으로 높았다(Fig. 5). 일반적으로 해양에서 유기탄소 중 DOC는 약 80~90%를 차지하며(Bates and Hansell, 1999), viruses, macromolecules 등으로 주로 구성되어 있고, 해양생태계의 먹이망에서 원생동물의 먹이원으로 중요한 역할을 하고 있다(Sharp, 1973; Lee et al., 2004). 연안에 위치한 마산만에서는 풍부한 영양염의 공급으로 식물플랑크톤의 번성에 따라 일반적인 대양에 비해 상대적으로 유기탄소 중 POC가 차지하는 비율이 높게 나타났다(Rueler and Ades, 1987). 계절별 비율을 살펴보면 클로로필 a의 농도가 높았던 시기에 유기탄소 중 POC가 차지하는 비율이 50% 이상이었다(Figs. 2, 5).
DOC 농도는 표층 및 저층에서 각각 0.15~5.08 mg L-1 (1.56±0.63 mg L-1), 0.59~5.14 mg L-1 (1.33±0.61 mg L-1) 범위였다(Tables 1, 2). 표층에서는 시기적으로 2월 5일에 평균 0.77 mg L-1로 낮았고, 8월 8일에 평균 2.28 mg L-1로 높았으며, 공간적으로는 마산만 내측(정점 M1~M3)에서 0.46~5.08 mg L-1 (1.93±0.63 mg L-1)로 그 외 정점에 비해 평균 1.3배 이상 높았다. 2008년 8월에 동해 남서부해역의 DOC 농도는 56~104 μM (0.67~1.25 mg L-1) 범위로 육지와 인접한 정점에서 농도가 높았다(Kim and Kim, 2010). 또한 2003년부터 2006년까지 갈수기(5월)와 풍수기(7월 또는 8월)에 새만금 방조제 내측 표층 해역에서 DOC 농도는 1.00~12.2 mg L-1 범위로 만내측에서 농도가 높았다(Park et al., 2009). 대체적으로 DOC 농도는 마산만과 새만금 내측처럼 육지와 인접한 반폐쇄적인 연안에서 조사시기와 조사위치에 따라 5~10배 이상 농도차를 보이며, 다양한 계절적 공간분포 및 내측의 높은 농도는 수질변화에 잠재적인 원인으로 작용될 수 있으므로 지속적인 모니터링을 통한 고찰이 필요하다.
마산만의 POC 농도는 표층과 저층에서 각각 0.14~10.00 mg L-1 (1.41±1.46 mg L-1), 0.14~5.05 mg L-1 (0.85±0.69 mg L-1) 범위였다(Tables 1, 2). 4월 9일에 평균 0.38 mg L-1로 가장 낮았고, 6월 23일에 평균 3.04 mg L-1로 높았다(Fig. 4). 공간적으로는 마산만 내측(정점 M1~M3)에서 평균 2.25 mg L-1로 그 외 정점(평균 1.15 mg L-1)보다 약 2배 높았다. 새만금 방조제 내측 표층에서는 2003년부터 2006년까지 갈수기(5월)와 풍수기(7월 또는 8월)에 0.1~38.0 mg L-1 범위로 갈수기에 수심이 얕은 지점에서 농도가 높았으며, 이는 저층 퇴적물의 영향을 받았을 가능성을 시사했다(Park et al., 2009). 섬진강하구에서는 1999~2001년(10회 조사)동안 POC 농도가 0.2~2.3 mg L-1 범위로 육지와 인접한 담수구간에서 높게 나타나(Kwon et al., 2002), 육지와 인접한 내만에서 집중적인 관리가 필요할 것으로 판단된다.
3.4 이론적산소요구량(TOD)을 이용한 COD 산화효율성 추정
마산만 표층 연평균 COD 농도(2.85±1.67 mg L-1)와 TOC 농도(2.97±1.69 mg L-1)는 유사하였으며(Table 1), COD와 TOC 농도 사이에 좋은 양의 상관성(R=0.817, p<0.01)을 보였다. 일본의 Omura만에서 조사된 결과에 의하면, 해수의 교환이 활발한 정점(R=0.438) 보다 해수가 정체된 정점에서 두 항목의 상관성(R=0.801)이 좋은 것으로 나타났다(Yuya et al., 2012). 해수교환이 활발하지 않은 마산만 내측(정점 M1~M3)에서 두 항목의 상관성은 0.8 (p<0.01) 이상으로 비교적 좋았다. 반면 외측에 위치한 정점 M9에서 두 항목 간 상관성이 가장 낮았고, 이는 8월 중순에 TOC 농도가 COD 농도에 비해 약 3배 높게 나타나 상관성에 영향을 미친 것으로 보인다. 이 시기에 정점 M9에서 클로로필 a 농도(76 μg L-1)가 높아 식물플랑크톤이 COD의 분석결과에 영향을 미친 것으로 추측된다.
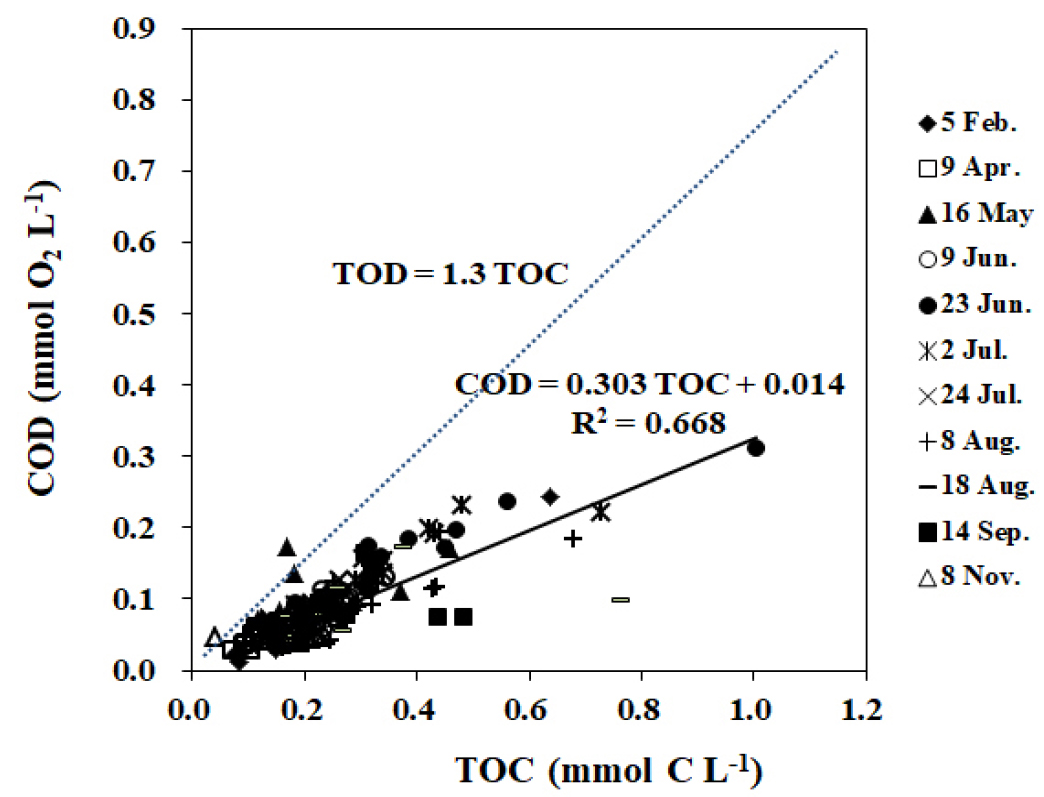
해수 중 TOC에 대한 COD 분석법을 이용한 유기물의 산화효율을 추정하기 위해서 이론적산소요구량(TOD: Theoretical Oxygen Demand)을 구하였다(Son et al., 2003; MOF, 2018a). 해수 중 유기물의 조성비는 redfield ratio를 따른다고 가정하였을 때, TOC에 대한 유기물의 TOD 관계식은 아래와 같이 유기물 산화-환원 반응식으로부터 산출할 수 있다.
식 (1)에서 1 mol의 탄소량을 산화시키는데 필요한 산소량은 1.3 mol이다(Fig. 6). 위 관계식을 바탕으로 2015년 마산만 표층수 중 COD (mg L-1)와 TOC (mg L-1) 농도를 C 질량수 12 g과 O2 질량수 32 g을 이용하여 몰농도로 환산하여 두 항목간의 상관관계를 살펴보았다(Fig. 6). 식 (1)에서 도출된 TOD 상관관계식(TOD = 1.3 × TOC)과 2015년에 마산만 표층수에서 조사된 TOC와 COD의 몰농도 사이의 관계식(COD = 0.303 × TOC + 0.014)의 기울기 값을 통해 추정한 총유기탄소(TOC)에 대한 COD의 유기물 산화 효율은 약 23% (0.303/1.3)였다(Table 3, Fig. 6).
Table 3.
COD oxidation efficiency in surface seawater of Masan Bay during 2015
조사 시기별 COD의 산화 효율은 7~39%의 범위로, 4월 9일에 가장 좋았고(39%), 8월 18일부터 11월까지 산화 효율이 7% 내외로 상대적으로 낮았다(Table 3). 8월 중순 이후 11월까지 TOC와 COD의 결정계수(R2)는 0.2 이하로 상관관계가 좋지 않았다. 이들 시기에 일부 정점(8월 18일 정점 M9; 9월 14일 정점 M1, M2)에서 TOC에 대한 COD의 몰농도 비율이 상대적으로 낮아 전체적으로 산화 효율이 낮게 나타났다. 이들 정점들을 제외하면 8월 19일과 9월 14일에 산화 효율은 각각 38.6% (0.502/1.3)와 46.1% (0.599/1.3)로 증가하였다.
조사 정점별 TOC에 대한 COD의 산화 효율은 약 9~33%의 범위로 정점 M4와 M6에서 가장 높았고, 정점 M9에서 가장 낮았다(Table 3). 정점 M9에서 8월 18일에 조사된 클로로필 a 농도(76 μg L-1)가 상당히 높게 나타났으며, 이 시기에 TOC에 대한 COD의 몰농도 비율이 낮게 나타나 산화 효율 결과에 영향을 미친 것으로 판단된다. 8월 18일 정점 M9에서 조사된 결과를 제외하면 TOC에 대한 COD의 산화 효율은 약 37.3% (0.485/1.3)로 증가하였다. 따라서 조사 시기별, 조사 정점별 유기물에 대한 COD 분석법의 산화 효율은 상당한 편차를 보여주고 있으며, 이는 조사 시료의 수에 영향을 많이 받는 것으로 판단된다. 따라서 조사 시기와 조사 정점별 정확한 산화 효율을 추정하기 위해서는 많은 자료수의 확보가 필요하며, 또한 마산만 내에서 총유기탄소에 대한 COD의 산화 효율을 추정하기 위해서는 만내에 존재하는 유기물의 성상(자생 유기물, 난분해성 유기물 등)에 대한 추가적인 조사가 필요할 것으로 판단된다(Eom et al., 2012; Park et al., 2018).
일반적으로 해양에서 COD 분석시 유기물의 산화 효율은 30~50% 정도로 제시되어 있다(MOF, 2018a). 또한 1999년 9월, 12월 및 2000년 1월, 4월에 인천연안, 형산강 하구, 부산연안에서 추정한 COD의 산화 효율은 약 47% (Son et al., 2003)로 본 연구에서 추정한 COD 산화 효율(약 23%) 보다 높았다. 이는 마산만 해수의 유기물 중 난분해성 물질들이 상대적으로 많이 존재하기 때문인 것으로 판단된다(Price et al., 1974). 또한 COD와 TOC 분석법 차이로 인해, 즉 COD 분석은 유기화합물의 조성에 따라 유기물의 분해 속도에 차이가 발생하고, TOC 분석은 고온산화방식으로 유기물의 분해 속도에 의존하지 않기 때문에(Yuya et al., 2012), TOC 분석 결과에 비해 COD 농도가 낮게 나타날 수 있으므로 상대적으로 산화 효율에 영향을 미치는 것으로 판단된다. 이러한 이유로 유기물의 산화 효율성이 낮은 COD 농도는 마산만 연안오염총량관리제도의 시행 및 평가 결과를 도출하는데 유기물을 과소평가 할 우려를 범할 수 있다. 따라서 COD와 TOC 농도 간의 비교 분석이 필요하며, 다양한 환경 요인과의 연관성을 검토해야 한다. 현재 해수의 오염 지표로 널리 사용되고 있는 COD를 TOC로 단기간에 대체하는 것은 혼란을 야기시킬 수 있으나, COD와 TOC 분석을 병행 조사하여 자료를 축적한 후 점진적으로 TOC 항목을 오염 지표 항목으로 대체해 나가는 것을 검토할 필요가 있다.
4. 결 론
유기물 농도는 오염부하량이 증가하는 6~8월에 다른 시기에 비해 상대적으로 높았으며, 특히 표층에서 저층보다 약 2배 높았다. 여름에 형성된 성층화로 인해 수직적 물질교환이 제대로 이루어지지 않는 상태에서 표층에서는 육상으로부터 유기물 또는 만내 자생유기물의 공급 등으로 유기물 농도가 저층보다 높게 나타난 것으로 판단된다. 한편 저층에서는 성층화로 인해 표층으로부터 산소 공급 차단, 유기물 분해 등의 영향으로 DO 및 유기물 농도가 낮게 나타났다. COD와 TOC 농도는 마산만 외측에 비해 내측(정점 M1~M3)에서 약 2배 이상 높아서 내측에 대한 집중적인 관리가 필요하다. 표층에서 유기물에 의한 COD 산화 효율은 연간 약 23%였고, 시기적으로는 4월에, 공간적으로는 만 외측보다는 내측에서 비교적 COD 산화 효율이 높은 편이었다. 조사 시기별, 조사 정점별 유기물에 대한 COD 산화 효율의 편차는 크게 나타났으며, 이는 조사 자료수의 부족으로 인하여 일부 자료에서 편차가 크게 나타나, 향후 더 많은 자료의 확보가 필요할 것으로 판단된다.
본 연구 결과에서 도출된 COD 산화 효율(23%)은 해양환경공정시험기준에서 제시하고 있는 값(30~50%) 보다 낮아서, 마산만에서 COD 분석을 통한 유기물 농도는 다소 과소평가 될 우려가 있다. 따라서 연안에서 유기물의 지표로 주로 이용되는 COD는 TOC 농도와 지속적인 비교 검토가 필요하며, 향후 해수내 유기물의 거동을 평가하는 지표로서 TOC 항목의 적용범위를 확대할 필요성이 있다.