1. 서 론
2. 재료 및 방법
2.1 잘피 채취 및 보관
2.2 광합성률 및 호흡률 측정
2.3 전체 식물의 탄소수지(whole-plant carbon balance)
2.4 표층 수온
2.5 통계분석
3. 결 과
3.1 광합성 특성 및 호흡률 변화
3.2 새우말의 탄소수지
3.3 표층 수온 장기적 변동
4. 고 찰
4.1 수온 변화에 따른 새우말의 광합성 특성 및 호흡률
4.2 새우말 전체 식물 탄소수지(whole-plant carbon balance)의 계절적 변동
1. 서 론
현재 지구는 인간의 영향에 의해 유례없이 빠른 속도로 기후 온난화가 진행되고 있다. IPCC 6차 보고서에 따르면 2011–2020년 해양의 온도는 산업화(1850–1900년) 이후 0.88°C(범위: 0.68–1.01°C) 상승하였으며(IPCC, 2021), 특히 연안에서의 수온 증가가 가속화되고 있다(Oczkowski et al., 2015). 이러한 수온 상승은 해양생물들의 생리, 행동, 생활사 등에 직·간접적으로 영향을 미친다(Doney et al., 2012; Poloczanska et al., 2013; Birchenough et al., 2015). 잘피(seagrass)는 해수에 적응하여 살아가는 현화식물(marine angiosperm)을 통칭하며, 약 60–70여종이 남극을 제외한 전세계 연안에 분포하고 있다(McKenzie et al., 2020; Strydom et al., 2023). 기후 변화로 인한 수온 상승은 잘피의 분포, 생활사 및 종 조성 변화 뿐만 아니라(Wernberg et al., 2016; Qin et al., 2020), 생육지가 대규모로 소실되어 잘피생태계가 제공하는 중요한 생태적·경제적·사회적 서비스들의 변화를 일으킨다(Nguyen et al., 2021). 호주의 Shark Bay에서 2010/2011년 여름의 평균 수온이 2–4°C 높게 약 2개월간 지속되어 ~1300 km2의 잘피 생육지가 사라졌다고 보고되었으며(Arias-Ortiz et al., 2018), IPCC 특별보고서(Special Report on Emissions Scenarios)의 A1B 배출시나리오에 따르면, 지중해에 분포하는 Posidonia oceanica는 2049년에 현재 생육밀도의 10%까지 감소하는 것으로 예측되었다(Jordà et al., 2012). 따라서, 수온 변화에 따른 잘피의 생리생태학적 반응을 예측하는 것은 향후 기후 변화에 따른 연안 및 하구생태계의 효과적인 보전·관리 방안을 제시하는데 중요하다.
탄소수지(carbon balance)는 환경 변화에 따른 식물의 다양한 반응을 평가할 수 있으며, 특히 스트레스에 대한 식물의 생리적 반응을 예측할 수 있는 지표로 사용할 수 있다. 잘피의 탄소수지는 광합성을 통해 흡수되는 탄소와 호흡을 통해 이용되는 탄소를 통해 평가될 수 있으며(Moreno-Marín et al., 2018), 잘피의 광합성-광도(photosynthesis-irradiance; P-I) 반응으로부터 도출된 광합성 매개변수들과 호흡률을 통해 추정할 수 있다. 잘피의 광합성이 호흡을 통한 탄소요구량을 초과할 경우 양의 탄소수지(positive carbon balance)를 나타내지만, 호흡이 광합성을 통해 흡수되는 탄소량을 초과할 때 음의 탄소수지(negative carbon balance)를 나타낸다(Lee et al., 2007). 잘피는 광합성을 하지 않는 지하부 조직이 생체량의 많은 부분을 차지하고 있어 식물플랑크톤이나 해조류에 비해 빛 요구량이 더 높다(Lee et al., 2007; Tanaka and Nakaoka, 2007). 이와 같이 지하부 조직의 비율은 잘피의 탄소수지 추정에 영향을 미치기 때문에 지하부를 포함한 전체 개체를 이용하여 실험해야 한다.
광합성-광도 곡선(photosynthesis-irradiance curve; P-I curve)은 광도 변화에 따른 식물의 광합성 반응을 나타내며, 잘피의 광합성-광도 곡선은 다양한 환경요인들에 의해 영향을 받으며 계절적 경향이 뚜렷하다(Beca-Carretero et al., 2018; Moreno-Marín et al., 2018). 수중광량 및 수온은 잘피의 광합성에 가장 크게 영향을 미치는 환경 요인들이며, 잘피의 생장, 생존 및 분포 등을 결정한다(Lee et al., 2007). 특히 잘피의 대사율은 수온에 큰 영향을 받는데, 일반적으로 수온이 증가할수록 잘피의 광합성 및 호흡은 증가하게 된다. 잘피는 수온이 높은 여름에 호흡량의 증가로 인해, 양의 탄소수지를 유지하기 위해 더 많은 빛이 필요한데, 이 때 빛이 감소하게 되면 잘피의 생장이 크게 저해되어 생존이 위협될 수 있다(Staehr and Borum, 2011; Said et al., 2021).
대부분의 잘피는 연성저질에 생육하지만, 새우말속(Genus Phyllospadix)의 잘피종들은 조류 및 파랑에너지가 강한 암반에 부착하여 생육하는 것이 특징이다. 5종의 새우말속 잘피들은 오직 북태평양 연안에만 분포하고 있으며, 국내에는 게바다말(P. japonicus)과 새우말(P. iwatensis) 2종이 분포하고 있다(Lee et al., 2018). 이들은 접근하기 어려운 환경에 분포하여 상대적으로 연구들이 적으며, 주로 생장 특성에 대한 연구들이 수행되었다(Park and Lee, 2009; Kim et al., 2018; Park et al., 2019; Kim et al., 2022). 우리나라 연안에 분포하는 게바다말은 약 14°C, 새우말은 약 13°C에서 생산성이 가장 높았다(Park and Lee, 2009; Kim et al., 2018). 이와 같이 새우말속 잘피종들은 다른 온대 해역 잘피종들에 비해 비교적 낮은 수온에 최적의 생장을 보여 냉수 적응 종(cold water-adapted species)로 간주된다. 따라서 이들은 가파른 수온 상승에 의해 큰 영향을 받을 것으로 추정된다. 본 연구는 향후 기후변화에 의한 수온 상승이 새우말의 탄소수지에 미치는 영향을 예측하기 위해 수온 변화에 따른 광합성 및 호흡률의 변화를 측정하였으며, 이들 광합성 및 호흡률과 현장에서 측정된 수중광량, 수온 및 생체량을 토대로 전체 식물의 탄소수지(whole-plant carbon balance)를 추정하였다.
2. 재료 및 방법
2.1 잘피 채취 및 보관
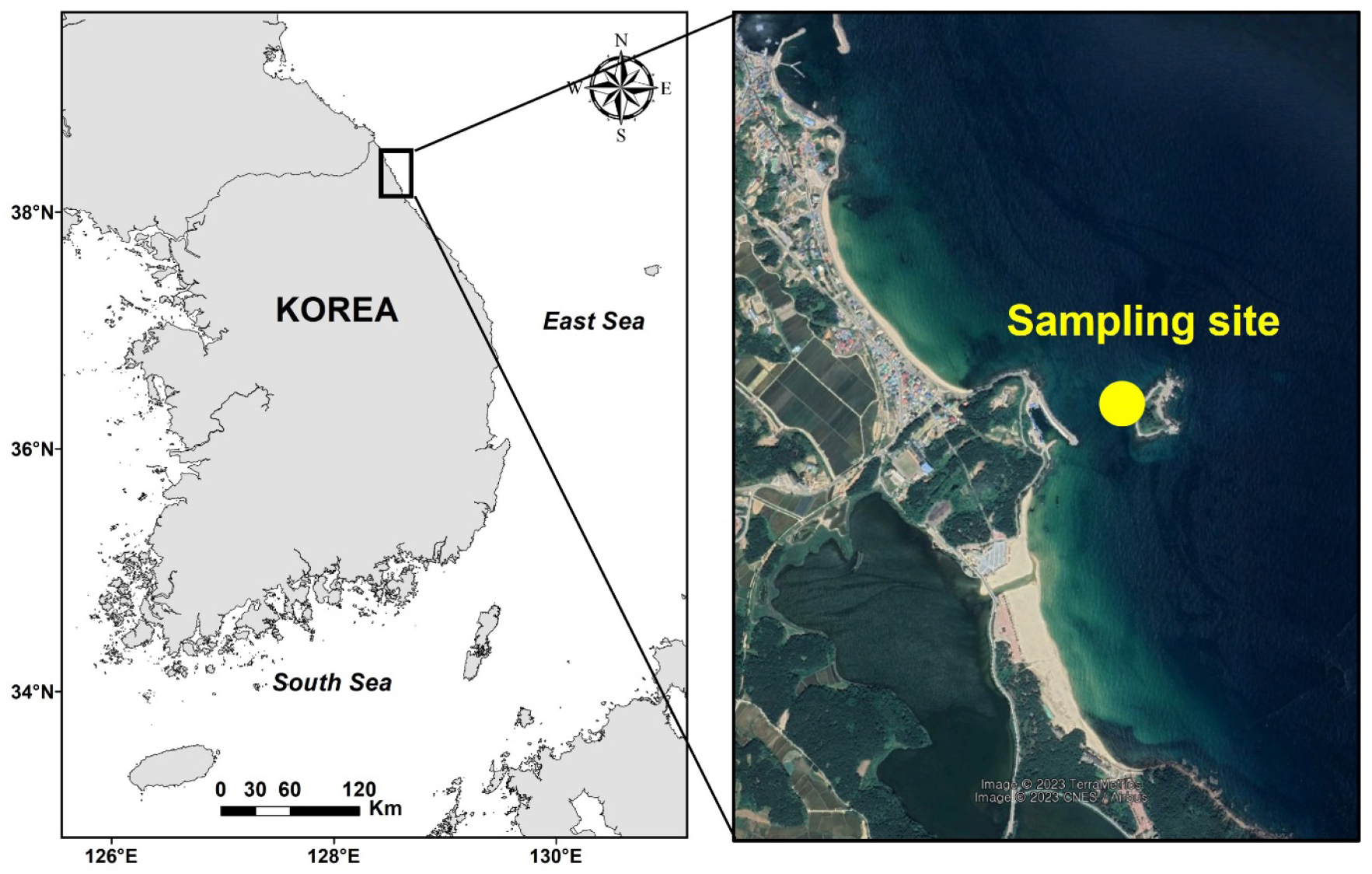
본 연구는 우리나라 동해 연안 강원도 고성군 현내면 초도리 연안(38° 29′ 11″N, 128° 26′ 35″E)에 분포하는 새우말을 2017년 10–12월에 채취하여 수행하였다(Fig. 1). 시료 채취 장소는 외해에 노출되어 있어 파도의 영향을 많이 받았으며, 조차는 반일주조(semi-diurnal)로 평균 ~30 cm이며, 수심 ~2–8 m의 암반에 새우말 단일종이 넓게 분포하고 있다. 새우말의 지상부 조직(잎, 엽초)과 지하부 조직(지하경+뿌리)을 포함한 전체 개체를 조심스럽게 채취한 후, 해수를 채운 아이스박스에 담아 기포기로 지속적으로 공기를 주입하며 실험실로 운반하였다. 운반된 새우말 개체들은 여과된 해수를 사용하여 부착생물 및 이물질을 깨끗하게 제거하였다. 광합성 및 호흡률을 측정하기 전까지 새우말 시료는 온도가 조절 가능한 배양실에서 포화광도 이상의 빛(~400 μmol photons m–2 s–1)을 조사하여 보관하였으며, 하루에 한 단계씩 낮은 수온부터 총 6단계의 수온(5, 10, 15, 20, 25, 30°C)에 적응시켰다. 실험에 사용한 해수는 현장에서 채수하여 유리섬유필터(glass microfiber filter; 47 mm GF/CTM, Whatman, Piscataway, New Jersey, USA)로 여과한 후 고압멸균하였다. 새우말의 광합성 및 호흡률 측정은 시료가 채취된 후 1주일 이내에 완료하였다.
2.2 광합성률 및 호흡률 측정
광합성률 및 호흡률은 해수로 채워진 투명한 원통형 챔버(직경: 6.5 cm, 높이: 40 cm) 내에 새우말 1개체를 넣은 후 밀폐하여 용존 산소 농도의 변화율을 측정하였다. 챔버 내 용존 산소 농도는 2-mm O2 센서가 연결된 4채널 광섬유 산소 측정기(OXY-4 mini; PreSens Precision Sensing GmbH, Regensburg, Germany)를 이용하여 측정하였다. 실험 전 O2 센서는 0% 및 100% 산소 포화도(0% & 100% air saturation)를 이용하여 보정하였다. 챔버 내 해수는 N2 가스를 사용하여 실험 초기 산소 포화도를 ~20%로 낮췄으며, 실험 중에 산소 포화도는 ~20–80% 수준으로 유지하였다. 또한 자력 교반기 및 교반 막대를 사용하여 챔버 내 해수의 용존 산소 농도를 균질하게 유지하여 확산경계층(diffusive boundary layer)을 최소화하였다. 각 수온처리(5, 10, 15, 20, 25, 30°C)마다 총 8단계의 광도(0, 8, 34, 90, 200, 400, 600, 850 μmol photons m–2 s–1)을 조사하였다. 낮은 광도부터 단계별로 용존 산소 농도 변화의 기울기가 직선이 될 때까지 약 1시간 정도 측정한 후, 2시간 이상 암적응 이후 호흡률을 측정하였다. 챔버 실험 종료 후, 새우말 개체는 지상부 조직과 지하부 조직으로 분리하여 60°C에서 일정한 무게가 될 때까지 건조한 후 각각의 건중량(g DW)을 측정하였다. 새우말의 광합성률 및 호흡률 측정 실험은 각 수온처리마다 8개의 챔버를 사용하여 실험하였다(n=8).
각 광도 단계별 총광합성률(gross photosynthetic rate, PG; μmol O2 g–1 DW h–1)은 챔버 내 용존 산소 변화율을 토대로 순광합성률(net photosynthetic rate, PN)과 호흡률(respiration, R)을 추정한 후, 지상부 조직의 건중량을 이용하여 아래와 같이 계산하였다.
각 광도 단계별 총광합성률을 쌍곡선 탄젠트(hyperbolic tangent) 함수를 이용하여 광합성-광도 곡선을 도출한 후(Jassby and Platt, 1976), 최대총광합성률(Pmax) 및 광합성 효율(α)을 도출하였다.
또한 포화광도(Ik) 및 보상광도(Ic)를 아래와 같이 계산하였다(Dunton and Tomasko, 1994).
2.3 전체 식물의 탄소수지(whole-plant carbon balance)
새우말 전체 식물의 탄소수지는 단위 면적당 일일 순광합성 생산성(net photosynthetic production on an areal basis, PN-areal)으로 정의하였다. 2017년 7월부터 2018년 8월까지의 일일 총광합성 생산성(daily photosynthetic production, PG(integrated)), 호흡률(R) 및 새우말의 생체량(B)을 이용하여 새우말 전체 식물의 탄소수지를 추정하였다.
일일 총광합성 생산성(PG(integrated))은 광합성-광도 곡선으로부터 도출된 광합성 매개변수(Pmax, α) 및 새우말 생육지에서 측정된 일일 평균 수중광량(I)과 수온을 사용하여 계산하였다. 일일 평균 수온은 ≤ 7.5°C, 7.5–12.5°C, 12.5–17.5°C, 17.5–22.5°C, ≥ 22.5°C로 세분화하고, 각 수온처리(5, 10, 15, 20, 25°C, respectively)에서 도출된 광합성 매개변수를 각각의 수온에 해당하는 일에 대입하였다(Table 1). 이후 광합성 생산성을 통합하여 일일 총광합성 생산성(PG(integrated))을 추정하였다.
단위 면적당 일일 총광합성 생산성(PG-areal) 및 단위 면적당 일일 총호흡량(Rareal)은 새우말의 지상부 생체량(Babove)과 총 생체량(Btotal)을 이용하여 계산한 후, 단위 면적당 일일 순광합성 생산성(PN-areal)을 아래와 같이 도출하였다.
Table 1.
The range of in situ water temperature applied to each target temperature treatment and the mean values of adjusted maximum gross photosynthetic rate (Pmax; μmol O2 g−1 DW h−1), photosynthetic efficiency (α; μmol O2 g−1 DW h−1/μmol photons m−2 s−1), and respiration rate (R; μmol O2 g−1 DW h−1) of Phyllospadix iwatensis at each target temperature treatment for estimation of the daily photosynthetic production
2017년 7월부터 2018년 8월까지 새우말 전체 식물의 탄소수지를 추정하기 위해 사용된 수중광량, 수온 및 생체량은 Kim et al.(2018)의 데이터를 인용하였다(Table 2).
Table 2.
Underwater irradiance, water temperature, above-ground and total biomass, and proportion of below-ground to total biomass of Phyllospadix iwatensis at the study site on the east coast of Korea from August 2017 to July 2018 for estimation of the whole-plant carbon balance. These data adapted from Kim et al.(2018)
2.4 표층 수온
새우말 생육지의 장기적인 표층 수온(sea surface temperature; SST)의 변화 양상을 파악하기 위해, 국립수산과학원 한국해양자료센터(Korea Oceanographic Data Center, National Institute of Fisheries Science)에서 제공하는 연안정지관측자료를 사용하였다. 새우말 채취장소에서 약 30km 떨어진 속초 관측소(38° 12′ 31″N, 128° 36′ 18″E)에서 1967년 4월부터 2018년 12월까지 측정된 표층 수온을 사용하여 월평균, 연평균, 연최저 및 연최고 표층 수온(monthly SST, SSTmean, SSTmin, SSTmax)을 분석하였다. 표층 수온 자료가 누락된 1967년, 2011년, 2014년은 분석에서 제외하였다(1967년 1–4월, 2011년 6–12월, 2014년 1–12월).
2.5 통계분석
모든 측정치는 평균 ± 표준오차(mean ± SE)로 나타내었고, 통계분석은 SPSS 27.0 (SPSS Inc., Chicago, Illinois, USA)을 사용하였다. 분석 전 모든 자료는 정규성(normality)과 등분산성(homogeneity of variance)을 검정하였으며, 가정이 만족되지 못한 자료들은 로그 변환 또는 비모수 검정법(non-parametric test)을 사용하였다. 수온 변화에 따른 최대총광합성률, 광합성 효율, 호흡률의 차이는 일원배치 분산분석(one-way ANOVA), 수온 변화에 따른 포화광도, 보상광도, Pmax:R 비율은 Welch’s ANOVA로 분석하였다. 분석 값이 유의한 경우(p < 0.05), Student-Newman-Keuls test와 Games-Howell test를 사용하여 사후검증하였다. 또한 연평균, 연최저 및 연최고 표층 수온의 장기적 변동 양상 파악을 위해 선형회귀분석을 수행하였다.
3. 결 과
3.1 광합성 특성 및 호흡률 변화
광합성-광도 곡선은 수온에 따라 다른 반응을 보였으며, 낮은 광도에서는 빛이 증가함에 따라 총광합성률(PG)은 빠르게 증가하나, 최대총광합성률(Pmax)에 도달한 이후 포화되는 일반적인 경향성을 보였다(Fig. 2). 본 실험에서는 높은 광도에서 나타날 수 있는 광저해(photoinhibition) 현상이 관찰되지 않았다.
수온 처리에 따라 최대총광합성률(Pmax)은 유의한 차이(one-way ANOVA: F5,42 = 36.336, p < 0.001)를 보였지만, 광합성 효율(α)은 유의한 차이(one-way ANOVA: F5,42 = 1.471, p = 0.220)를 보이지 않았다(Fig. 3A, 3B). 새우말의 최대총광합성률은 수온이 상승함에 따라 증가하여 20°C에서 최대값(101.65 μmol O2 g–1 DW h–1)을 보인 후, 30°C에서 급격히 감소하여 최소값(41.57 μmol O2 g–1 DW h–1)을 보였다(Fig. 3A). 광합성 효율은 0.78–1.08 μmol O2 g–1 DW h–1/μmol photons m–2 s–1의 범위 값을 보였다(Fig. 3B).
수온 변화에 따른 새우말의 포화광도(Ik) 및 보상광도(Ic)는 모두 유의한 차이(Welch’s ANOVA: F5,19.084 = 36.079, p < 0.01; F5,19.085 = 15.917, p < 0.001, respectively)를 보였다(Fig. 3C, 3D). 새우말의 포화광도는 67.69–124.50 μmol photons m–2 s–1의 값을 보이며 20–25°C까지 증가하다가 30°C에서 급격히 감소하였고, 보상광도는 수온이 증가할수록 점차 증가하는 경향을 보였다(Fig. 3C, 3D).
새우말의 호흡률은 수온에 따라 유의한 차이(one-way ANOVA: F5,42 = 33.519, p < 0.001)를 보였다. 수온이 증가할수록 호흡률이 점차 증가하는 경향을 보였으며, 호흡으로 인해 소모되는 산소의 양은 5°C에서 최소값(–10.08 μmol O2 g–1 DW h–1)을, 30°C에서 최대값(–36.89 μmol O2 g–1 DW h–1)을 보였다(Fig. 3E). Pmax:R 비율 역시 수온 변화에 따라 유의한 차이(Welch’s ANOVA: F5,19.221 = 40.729, p < 0.001)를 보였으며, 수온이 증가할수록 Pmax:R 비율은 점차 감소하여 30°C에서 최소값(1.18)을 보였다(Fig. 3F).

Fig. 3.
Phyllospadix iwatensis. Maximum gross photosynthetic rate (Pmax; A), photosynthetic efficiency (α; B), saturation irradiance (Ik; C), compensation irradiance (Ic; D), respiration rate (E), and the ratio of maximum gross photosynthetic rate to respiration rate (Pmax: R ratio; F) at the various water temperature treatments. Different letters on the bars indicate significant (p < 0.05) differences. Values are means ± SE (n = 8).
3.2 새우말의 탄소수지
새우말의 탄소수지는 겨울에 비해 봄과 여름에 일일 변동이 심하게 나타났고(daily carbon balance), 월평균 탄소수지(monthly average carbon balance)는 뚜렷한 계절적 경향을 보였다(Fig. 4). 월평균 탄소수지는 여름에서 겨울까지(2017년 8월–2018년 2월)까지 음의 탄소수지를 보였으며, 이후 봄부터 초여름까지 점차 증가하다가 2018년 7월에 급격히 감소하였다. 새우말의 탄소수지는 11월에 –13.28 g C m–2 day–1에서 6월에 20.25 g C m–2 day–1의 범위를 보였다(Fig. 4).

Fig. 4.
Phyllospadix iwatensis. The estimates of daily and monthly average whole-plant carbon balance at the study site on the east coast of Korea from August 2017 to July 2018. Whole-plant carbon balance was assessed by utilizing seagrass biomass, dark respiration, and daily integrated photosynthetic production. The necessary data for this estimation, including underwater irradiance, water temperature, and biomass under in situ condition, were adapted from Kim et al.(2018).
3.3 표층 수온 장기적 변동
속초 연안정지관측소에서 측정된 월평균 표층 수온(monthly SST)은 일반적으로 2월에 가장 낮고, 8월에 가장 높은 전형적인 온대해역의 계절적 경향을 보였다(Fig. 5A). 연평균, 연최저 및 연최고 표층 수온(SSTmean, SSTmin, and SSTmax)은 지난 50년간 꾸준히 증가하는 경향을 보였다. 연평균 표층 수온은 1986년 11.30°C에서 2001년 16.70°C의 변화를 보였으며, 0.053 ± 0.009°C yr–1 (r2 = 0.411, p < 0.001)의 증가율을 보였다(Fig. 5B). 연최저(1.41–9.27°C) 및 연최고(19.49–26.49°C) 표층 수온은 연평균 표층 수온에 비해 큰 연간 변동을 보였다. 연최저 및 연최고 표층 수온은 지난 50년동안 0.073 ± 0.017°C yr–1 (r2 = 0.274, p < 0.001) 및 0.045 ± 0.015°C yr–1 (r2 = 0.164, p < 0.01)의 증가율을 보였다(Fig. 5C, 5D). 지난 50년 동안 속초 연안의 수온은 연최저 표층 수온이 연평균 및 연최고 표층 수온에 비해 가장 큰 증가율을 보였다(Fig. 5).

Fig. 5.
Monthly sea surface temperature (SST; A), annual mean (SSTmean; B), annual minimum (SSTmin; C), and annual maximum (SSTmax; D) SST on the east coast of Korea from April 1967 to December 2018. Data of SST were obtained from the Sokcho buoy station, Korea Oceanographic Data Center, National Institute of Fisheries Sciences, located ~30 km from the sampling site.
4. 고 찰
4.1 수온 변화에 따른 새우말의 광합성 특성 및 호흡률
광합성-광도 곡선은 광도 변화에 따른 식물의 광합성 반응을 예측하는데 유용하게 사용되며, 광합성률에 대한 다양한 생물학적·비생물학적 영향을 평가하는데 널리 사용된다. 본 연구에서 새우말은 약 70–125 μmol photons m–2 s–1의 광도에서 광합성이 포화되었지만, 800 μmol photons m–2 s–1 이상의 광도에서도 광저해가 나타나지 않았다. 또한 우리 동해 연안 최남단에 분포하는 게바다말의 경우에도 800 μmol photons m–2 s–1 이상의 높은 광도에서 광저해 반응이 발생하지 않았다(Kim et al., 2022). 새우말속 잘피종인 게바다말과 새우말은 퇴적물 부유가 상대적으로 적어 비교적 수중광량이 풍부한 동해 연안의 암반해역에 주로 분포하고 있다. 연 평균 수중광량은 동해 연안의 게바다말 생육지에서 ~46 mol photons m–2 d–1, 새우말 생육지에서 ~39 mol photons m–2 d–1이 측정되어(Kim et al., 2018; Park et al., 2019), 남해 연안의 잘피생육지(3.1–15.6 mol photons m–2 d–1)보다 현저히 높게 나타났다(Kim et al., 2008; Kim et al., 2012; Kim et al., 2014). 따라서 동해 연안에 분포하고 있는 새우말속 잘피종들은 비교적 높은 광량 조건에서 적응되어 있는 것으로 판단된다.
수온이 증가할수록 광합성-광도 곡선으로부터 도출되는 광합성 매개변수들은 일반적으로 증가하는 경향을 보인다(Staehr and Borum, 2011; Olivé et al., 2013; Georgiou et al., 2016). 본 연구에서는 광합성 효율을 제외한 나머지 매개변수들은 수온에 따라 유의한 차이를 보였다. 새우말의 최대총광합성률은 5–20°C에서 수온이 상승할수록 꾸준히 증가한 후 25°C부터 감소하여 30°C에서 급격히 감소하였다. 잘피는 일반적으로 수온이 증가할수록 광합성이 점점 증가하여 광합성 최적 온도(thermal optima; Topt)에 도달하며, 이후 수온이 증가할수록 광합성이 감소하게 된다(Collier et al., 2017). 연평균 수온이 비교적 일정한(15–21°C) 멕시코의 Baja California에 분포하는 Phyllospadix torreyi의 최대총광합성률은 16°C보다 25°C에 적응된 개체들이 높았으며(Vivanco-Bercovich et al. 2022), 우리 동해 연안의 최남단에 위치한 게바다말의 최대총광합성률은 5–25°C까지 꾸준히 증가하다가 30°C에서 급격히 감소하였다(Kim et al., 2022). 북반구 온대 해역에 우점하는 잘피종인 거머리말의 광합성 최적 온도는 위도에 관계없이 ~26–30°C를 나타내며, 이후 수온이 증가할수록 광합성이 감소한다(Staehr and Borum, 2011; Rasmusson et al., 2019). 또한 열대 및 아열대 해역에 분포하는 Halodule uninervis와 Cymodocea serrulata의 광합성 최적 온도는 ~35°C이며, 이후 수온이 증가할수록 광합성이 감소하였다(Collier et al., 2017). 본 연구 결과에 의하면 우리 연안에 분포하는 새우말의 광합성 최적 온도는 ~20°C로 사료된다.
본 연구에서 새우말의 호흡률은 수온이 상승할수록 꾸준히 증가하여 5°C에 비해 30°C에서 약 3.7배 더 높았다. 호흡률의 증가는 대사활동에 필요한 탄소요구량이 높아지는 것을 의미한다(Lee et al., 2007). 따라서 수온이 상승할수록 잘피는 생장 및 생존을 위해 더 많은 빛을 요구하여 보상광도가 증가하는 경향을 보이는데(Georgiou et al., 2016; Hansen et al., 2022), 본 연구에서도 수온이 상승할수록 새우말의 보상광도가 꾸준히 증가하였다. 잘피는 수온이 상승하면 대사활동이 활발해짐에 따라 광합성과 호흡률 모두 증가하지만, 호흡이 광합성에 비해 더 빠르게 증가한다고 보고되었다(Marsh Jr et al., 1986; Rasmusson et al., 2020). 본 연구에서도 새우말의 Pmax:R 비율은 수온이 가장 낮은 5°C에서 최대값을, 수온이 가장 높은 30°C에서 최소값을 보였고, 이는 수온이 증가함에 따라 호흡률이 광합성률에 비해 더 빠르게 증가한다는 것을 의미한다.또한 최대총광합성률은 20°C에서 최대값을 보인 후 30°C에서 급격히 감소하였으며, 새우말의 광합성이 30°C에서 저해됨을 의미한다. 반면에 호흡률은 수온이 증가할수록 점차 증가하여 30°C에서 최대값을 보였다. 이는 새우말이 30°C에서 극심한 고수온 스트레스 영향을 받는 것을 의미한다.
새우말의 광합성 매개변수 중 광합성 효율은 수온 변화에 따라 유의한 차이가 관찰되지 않았다. 플로리다에 분포하는 Halophila johnsonii의 광합성 효율은 고수온에서 높은 경향을 보였지만, 지중해에 분포하는 H. stipualcea는 저수온에서 높은 경향을 보였다(Torquemada et al., 2005; Georgiou et al., 2016). 우리 남해 연안의 해호말(H. nipponica)의 경우 수온 7–26°C에서 광합성 효율의 차이가 없었다(Kim et al., 2023). 이와 같이 다양한 잘피종이 수온 변화에 따라 광합성 효율이 다른 경향을 보이는 것은 다양한 환경 조건에서 탄소 고정(carbon fixation)을 최대화하기 위한 광적응(photo-acclimation) 과정이라 여겨진다.
우리 동해 연안 새우말속 잘피종인 게바다말과 새우말의 생산성은 ~13–14°C에서 최대인 것으로 보고되었다(Park and Lee, 2009; Kim et al., 2018; Park et al., 2019). 반면에 광합성 최적 온도는 게바다말이 ~20–25°C (Kim et al., 2022), 본 연구에서 새우말은 ~20°C로 추정되어, 생장 최적 온도보다 광합성 최적 온도가 높게 나타났다. 북반구 온대 해역의 우점 잘피종인 거머리말 역시 이와 같은 경향을 보인다. 우리 남해 연안 거머리말의 생장 최적 온도는 ~15–20°C이며, 이후 수온이 상승할수록 생산성이 급격히 감소한다(Lee et al., 2005). 하지만 국내와 스웨덴 및 덴마크 등지에 분포하는 거머리말의 최대총광합성률은 ~26–29°C까지 지속적으로 증가하였다(Rasmusson et al., 2019; Hansen et al., 2022; Kim et al., 2023). 잘피의 광합성 최적 온도와 생장 최적 온도는 대부분 일치하지 않으며, 일반적으로 광합성 최적 온도는 생장 최적 온도에 비해 높게 나타난다(Georgiou et al., 2016; Collier et al., 2017). 잘피의 생장은 광합성뿐만 아니라 무기영양염 농도, 호흡, 잎의 노화, 퇴적물의 생지화학적 과정 등 다양한 인자들에 의해 영향을 받기 때문이다(Lee et al., 2007; George et al., 2018; Hammer et al., 2018; Moreno-Marín et al., 2018).
4.2 새우말 전체 식물 탄소수지(whole-plant carbon balance)의 계절적 변동
다양한 환경 조건에서 광합성률 및 호흡률 측정을 통해 잘피의 생리학적 반응을 살펴보는 연구는 많이 진행되어 왔지만, 광합성률, 호흡률 및 현장의 생체량, 수중광량 측정을 통한 잘피의 탄소수지의 계절적 변동을 고찰한 연구는 많이 수행되지 않았다(Alcoverro et al., 2001; Kim et al., 2023). 본 연구에서 추정된 새우말의 탄소수지는 겨울부터 이른 여름까지 증가하고, 이후 여름부터 가을까지 감소하는 뚜렷한 계절적 경향을 보였다. 새우말은 늦은 여름부터 겨울까지 음의 탄소수지, 봄부터 초여름까지 양의 탄소수지를 보였다. 온대해역의 잘피종들은 여름철 고수온 시기에 호흡률 증가로 인해 양의 탄소수지를 유지하기 위해 더 많은 빛이 필요하게 되며, 이때 수중광량이 감소하게 되면 잘피는 고수온 스트레스에 매우 민감하게 된다. 본 연구에서 수온이 가장 높은 8–9월에 양의 탄소수지를 유지하기 위해 많은 양의 빛을 요구하지만, 6월 이후 지속적으로 수중광량이 감소하여 8–9월의 고수온 시기에 새우말이 음의 탄소수지를 나타낸다고 판단된다. 이는 현장에서 측정된 새우말의 생산성과 매우 유사한 경향을 보인다. Kim et al.(2018)의 연구에 따르면, 새우말의 개체당 잎 생산성(leaf productivity) 및 단위면적당 잎 생산성(areal leaf productivity)은 수온이 가장 높은 시기에 급격히 감소하여 겨울까지 지속적으로 낮은 생산성을 보였다. 이후 새우말의 생산성은 봄에 급격히 증가하고, 초여름부터 다시 생산성이 감소하는 경향을 보였다. 따라서 수온 변화에 따른 광합성률과 호흡률, 새우말의 생체량 및 수중광량을 통해 추정된 탄소수지는 현장에서 측정된 새우말의 생산성과 일치한다.
잘피의 지하부 생체량 역시 탄소수지에 영향을 미치는 중요한 요인 중 하나이다. 잘피의 지하경과 뿌리와 같은 지하부 조직은 광합성을 하지 않는 조직으로 이들의 대사활동은 잎조직에서 일어나는 광합성에 의해 유지된다. 따라서 잘피의 지하부 조직의 비율이 높을수록 호흡을 위한 에너지가 더 많이 필요하게 되고, 따라서 양의 탄소수지를 유지하기 위해 더 많은 빛이 요구된다. 본 연구에서 사용한 새우말 개체의 지하부 생체량 비율은 6–8월에 ~39–42%로 가장 낮고, 11–2월에 ~49–51%로 가장 높은 반면에 현장에서 측정된 수중광량은 여름 이후 점점 감소하여 겨울에 최저값을 보였다(Table 2; Kim et al., 2018). 따라서 새우말의 지하부 생체량 비율의 증가, 저수온에서 낮은 광합성률 및 수중광량의 감소로 인해 새우말이 겨울철에도 음의 탄소수지를 나타낸다고 판단된다.
지난 약 50년간 전 세계 표층 수온 증가율은 해역마다 큰 차이를 보이고 있으며, 특히 동아시아 해역의 표층 수온 증가율은 전 세계 평균 증가율에 비해 약 2–4배 높다고 보고되었다(Belkin, 2009). 국내 동해 연안 최북단에서 기록된 표층 수온 역시 지난 50년간 꾸준히 증가하고 있으며, 한반도 연안생태계의 물리화학적 환경요인 변화와 더불어 해양생물들의 종조성, 분포 및 대사활동에 많은 변화를 야기시킨다(Hyun et al., 2020). 본 연구와 이전 연구에 따르면 우리 동해 연안에 우점하고 있는 잘피종인 새우말과 게바다말은 ~15°C 이상에서 생산성이 감소하며(Park and Lee, 2009; Kim et al., 2018), ~20–25°C 이상에서 광합성 활동이 급격히 감소하였다(Kim et al., 2022). 새우말과 게바다말은 IUCN이 선정한 Red List에서 취약(vulnerable) 및 위기(endangered) 종으로 분류되어 멸종위기(threatened) 범주(취약, 위기, 위급)에 속한다. 따라서 기후 변화에 따른 지속적인 수온 상승은 우리 동해 연안 암반생태계 일차생산자의 종조성, 분포 등에 크게 영향을 미칠 것으로 판단되며, 이들의 효과적인 보전·보호·관리를 위해 실효성 있는 대책이 마련되어야 할 것이다.