1. 서 론
2. 재료 및 방법
2.1 채수 및 수질 분석
2.2 광노출 실험
3. 결 과
3.1 현장 물골 시료 내 수질분석 결과 및 종속영양 박테리아 개체수
3.2 물골 지하수의 광노출 실험
4. 고 찰
4.1 물골 지하수의 수질 특성
4.2 광노출 실험의 고찰
4.3 독도 물골 수질 개선을 위한 제언
1. 서 론
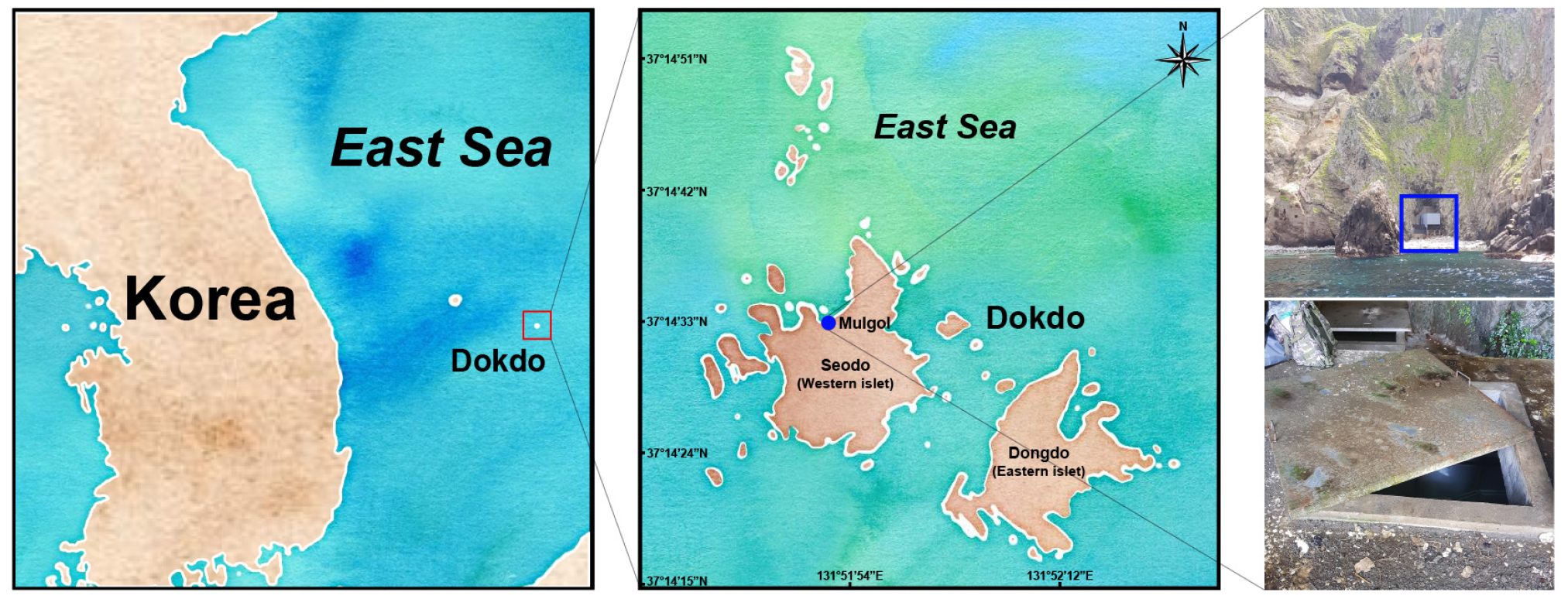
대한민국 천연기념물 제336호로 지정되어있는 독도는 동도와 서도인 2개의 큰 섬과 주위 89개의 작은 바위와 암초로 이뤄졌으며, 동도와 서도 사이의 거리는 약 151 m이다(경북대학교 울릉도·독도연구소, 2014, 2017, 2018). 동도와 서도의 면적은 각각 73,297 m2와 88,740 m2이며, 동도와 서도의 최고 높이는 각각 98.6 m와 168.5 m이다. 독도의 유일한 담수인 물골은 서도 북쪽의 조면암 지역에 위치하고, 물골의 담수는 물골 상류 지역의 토양이 두꺼운 지역에 내린 강우가 계곡의 절리를 따라서 아래로 이동하다가 투과되지 못하는 라필리응회암 지역에서는 더는 아래로 이동하지 못하고 측면에 있는 조면암 지역의 물골 쪽으로 흘러 모이는 것으로 여겨진다(국토해양부, 2010; 조 등, 2011). 2007년 서도에 담수화 시설이 구축되기 이전에 물골(가로 1.2 m, 세로 1.4 m, 깊이 1.68 m)은 공기 중에 노출된 물웅덩이로 독도 거주민을 위한 독도의 유일한 식수원으로 활용되었으며, 1953년~1956년 독도를 지키던 독도의용수비대의 식수원으로도 활용되었다. 하지만 지금은 수질 악화로 인해 음용수로 활용되지 못하고 역사적 상징물로 여겨지고 있으며, 2007년 이후 독도 주변에 서식하는 바닷새들의 사체 및 배설물의 물골 내 직접 유입으로 인한 물골 수질 악화를 차단하기 위해 저수조를 설치하여 덮개를 덮은 후 인위적으로 빛이 거의 없는 환경(~4 lux)으로 만들어 현재까지 유지되고 있다(Park, 2016; Park, 2017; Choi and Park, 2020).
독도 물골은 주변 환경을 고려할 때 독도 내 생태계에서도 매우 독특한 지하수로 여겨지지만, 접근성이 현격히 떨어져 연구가 많이 이루어지지 않았다. 2010년 이전에는 독도 물골 생태계 조사가 극히 드물었고(Shin et al., 2003), 본격적인 독도 물골 수질에 대한 정기 조사는 2010년 이후에 진행되었다(국토해양부, 2010; 조 등, 2011; 경북대학교 울릉도·독도연구소, 2014, 2017, 2018). 2010년 이후 조사 자료에 따르면 물골의 염분 변화는 주변 해무에 영향을 받으며, 강수량이 많을 때 일시적으로 염분이 증가하다가 강수가 지속되면 점차 희석되어 염분이 낮아지는 것으로 여겨진다(범위: 1.4~2.7 psu, 국토해양부, 2010; 조 등, 2011; 경북대학교 울릉도·독도연구소, 2014, 2017, 2018). 또한, 바닷새들의 배설물 등의 영향으로 물골 지하수의 용존 무기 질소(DIN: dissolved inorganic nitrogen) 함량이 매우 높은 것(>15 mg L–1)으로 나타났다(국토해양부, 2010; 경북대학교 울릉도·독도연구소, 2014, 2017, 2018). 그래서 물골 지하수 환경은 소량의 염이 존재하며 용존 무기 질소(주로 질산염)가 높은 기수 환경이라 할 수 있다.
일반적으로 질소 순환에서 용존 무기 질소(특히, 질산염)의 약 75% 정도는 식물플랑크톤에 의해 흡수되고, 약 25%는 종속영양 박테리아에 의해서 흡수된다(Fouilland et al., 2007). 하지만 독도 물골과 같은 광도가 매우 낮은 지역에서는 식물플랑크톤의 성장 억제로 인하여 질소화합물 등의 영양염이 물골 내에서 높을 것으로 예측되고, 주로 종속영양 박테리아에 의해서 질소화합물이 이용될 것으로 추정되지만 이를 규명하는 연구는 아직 수행되지 않았다. 더불어 독도 물골 지하수를 광노출 시켰을 때 시간에 따른 질소화합물과 미생물의 변화 및 이들의 관계를 규명하는 연구는 전무하다.
본 연구에서는 2020년 5월~11월 총 4차례에 걸쳐 독도 물골 현장 조사를 수행하였으며, 본 연구의 목적은 물골 지하수의 수질 평가와 광량이 매우 낮은 물골 지하수를 충분한 광량에 노출 시 물골 내 질소화합물 농도 및 미생물들의 변화 양상을 고찰하고자 하였다.
2. 재료 및 방법
2.1 채수 및 수질 분석
2020년 5월부터 11월까지 총 4회에 걸쳐 경상북도 울릉군 독도 물골(37°14'33"N, 131°51'52"E, Fig. 1) 지하수의 수질 분석 및 광노출 실험을 수행하였다. 현장 시료는 10% 염산을 사용하여 유기물을 제거한 폴리에틸렌 채수병을 직접 이용하여 표층수 20~45 L를 채수하였다. 채수된 일부 시료는 수질 분석을 위해 냉장 보관 후 경남과학기술대학교 환경측정검사센터에 의뢰하여 염분, pH, 용존산소량, 화학적 산소요구량, 부유물질량, 용존 무기 질소, 용존 무기 인을 측정하였다. 본 수질 항목은 환경부의 수질오염공정시험기준에 따라 측정을 진행하였다(환경부, 2020). 현장 시료 중 일부(60 ml)는 박테리아 및 미소편모류 개체수 측정을 위해 글루타르알데히드(최종농도 1%)로 고정하였으며, 현장 엽록소-a 측정을 위해 여과장치와 핸드펌프(300-4100, Thermo Fisher Nalgene, USA. MV8510, Mityvac, USA)를 사용하여 약 2 L 현장 시료를 ~0.7 µm 공극 크기의 유리섬유 여과지(Glass Microfiber Filter GF5-047, Chmlab, Spain)에 여과한 후 분석 전까지 냉동 보관하였다. 현장 엽록소-a는 실험실에서 빛이 없는 4°C 조건으로 90% 아세톤을 이용해 엽록소를 추출한 후 분광광도계(Lambda 265, PerkinElmer Ltd., USA)를 이용하여 측정하였다(환경부, 2020). 수온은 현장에서 염분-수온측정기(Salt 6+, Eutech Instruments Pte Ltd., Singapore)를 이용하여 측정하였다.
2.2 광노출 실험
물골 지하수는 주로 강우에 의해 생성되고, 매우 낮은 광도 및 높은 영양염 농도를 유지하고 있는 것으로 알려져 있다(경북대학교 울릉도·독도연구소, 2014, 2017, 2018). 본 실험은 매우 낮은 광도에 있었던 물골 지하수 시료를 상대적으로 높은 광도 조건에 노출 시 배양 시간에 따른 시료 내 질소화합물과 미생물 간의 관계를 규명하고자 빛이 투과되는 유리수조 또는 유리병에 물골 시료를 총 5~12 L씩 이중으로 담아 물골 수온과 유사한 15°C에서 배양하였다. 2020년 5월 실험은 자연 상태의 물골 환경(~4 lux)에 비해 200배 밝은 800 lux (~10.8 µmol m–2s–1)와 12:12 h L:D 광주기 조건에서 실험을 수행하였고, 이후 2020년 6월, 8월, 11월 실험은 낮은 광도로 인한 독립영양 미소편모류의 성장 제한 영향을 줄이기 위해서 5월 광노출 조건에 비해 높은 8,000 lux (~108 µmol m–2s–1)와 14:10 h L:D 광주기 조건에서 실험을 수행하였다(Thimijan and Heins, 1983; Dauta et al., 1990). 총 4회 수행한 광노출 실험은 12~17일 동안 진행되었고, 2~4일 간격으로 암모니아, 아질산염, 질산염 농도, 엽록소-a 농도, 종속영양 박테리아 개체수, 독립영양 또는 종속영양 미소편모류 개체수, pH를 측정하였다. 무기 질소(암모니아, 아질산염, 질산염) 농도는 분광광도계(HI 83200, Hanna instruments, USA)와 측정 시약들(HI93707, HI93715, HI93728, Hanna instruments, USA)을 이용하여 분광광도계 매뉴얼에 따라 측정하였고, 엽록소-a 측정은 ~0.7 µm 공극 크기의 유리섬유 여과지(Glass Microfiber Filter GF5-047, Chmlab, Spain)에 ~1 L 여과하고, 빛이 없는 4°C 조건에서 90% 아세톤을 이용해 엽록소를 추출한 후 분광광도계(Lambda 265, PerkinElmer Ltd., USA)를 이용하여 측정하였다(환경부, 2020). 개체수 측정을 위해 시료(20 ml)는 글루타르알데히드(최종농도 1%)로 빛이 없는 4°C에서 10분간 고정하였고, 박테리아와 미소편모류의 개체수 측정을 위해 각각 0.2 µm, 0.8 µm 공극 크기의 폴리카보네이트 막여과지(Whatman, UK)에 진공 펌프(DOA-P704-AC, Gast Manufacturing Inc., USA)를 사용하여 <100 mmHg로 여과하였다(Bloem et al., 1986). 시료를 여과한 필터지 위에 DNA 형광염료인 DAPI(4',6-diamidino-2-phenylindole dihydrochloride, Thermo Fisher Scientific, USA) 용액을 700 µl(최종농도 10 µg ml–1) 첨가 후 10분간 염색하고, 다시 여과한 후 형광 현미경(DM5500 B, Leica, Germany. BX53, Olympus, Japan)을 이용하여 종속영양 및 독립영양 미생물 개체수를 각각 325~375 nm 여기파장(exciation wavelength) 및 435~485 nm 방출파장(emission wavelength)과 465~495 nm 여기파장 및 590~650 nm 방출파장에서 측정하였다(Porter and Feig, 1980). pH는 pH 미터기(pH testr 30, Eutech Instruments Pte Ltd., Singapore)를 이용하여 측정하였다. 모든 무기 질소 농도 및 개체수는 이중(duplicate)으로 측정하였다. 광노출 실험에서 측정된 종속영양 박테리아와 질산염 간의 회귀 분석은 SPSS (v. 25.0) 프로그램을 이용하였다.
3. 결 과
3.1 현장 물골 시료 내 수질분석 결과 및 종속영양 박테리아 개체수
2020년 5월, 6월, 8월, 11월 총 4회에 걸친 독도 물골 현장 조사에서 수온과 염분은 각각 14.5~15.3℃와 1.39~1.57 psu였다(Table 1). pH는 약알칼리성이었으며, 범위는 7.7~8.0이었고, 용존산소량은 8.5~9.3 mg L–1였다(Table 1). 화학적 산소요구량과 용존 무기 인의 농도는 각각 1.2~6.2 mg L–1와 0.02~0.06 mg L–1였으며, 5월에서 11월로 갈수록 증가하는 경향을 나타냈다(Table 1). 특히, 낮은 부유물질량(범위: 0.8~5.1 mg L–1) 및 엽록소-a 농도(범위: <0.01~0.49 µg L–1)에도 불구하고 상당히 높은 농도의 용존 무기 질소가 측정되었다(범위: 35.9~47.2 mg L–1, Table 1). 따라서 물골 지하수는 염분을 함유하고, 용존 무기 질소 농도가 매우 높으며, 엽록소-a가 낮은 수질 특성을 나타내었다. 2020년 5월~11월 총 4회에 걸친 조사에서 종속영양 박테리아 개체수는 0.14~0.62 ×105 cells ml–1였고, 5월에 가장 낮은 값을 나타냈으며, 11월에 가장 높은 값을 보였다(Table 1).
Table 1.
Environmental parameters of water quality in the Mulgol pond on Dokdo, Republic of Korea
| Date (mm/dd/yy) | 05/06/2020 | 06/01/2020 | 08/19/2020 | 11/13/2020 |
| Temperature (℃) | 14.9 | 14.5 | 15.3 | 14.8 |
| Salinity (psu) | 1.57 | 1.52 | 1.55 | 1.39 |
| pH | 7.8 | 7.7 | 8.0 | 7.9 |
| DO (mg L–1) | 8.8 | 9.3 | 8.5 | 9.0 |
| COD (mg L–1) | 1.2 | 3.0 | 4.3 | 6.2 |
| SS (mg L–1) | 0.8 | 2.1 | 5.1 | 2.6 |
| DIN (mg L–1) | 47.2 | 42.4 | 35.9 | 41.8 |
| DIP (mg L–1) | 0.02 | 0.02 | 0.04 | 0.06 |
| Chl-a(µg L–1) | 0.49 | <0.01 | 0.13 | 0.03 |
| Bacteria (×105 cells ml–1) | 0.14 | 0.58 | 0.50 | 0.62 |
3.2 물골 지하수의 광노출 실험
물골 지하수의 높은 질소화합물 농도와 광노출과의 관계를 규명하고 향후 물골 수질 개선의 기초 자료로 활용하고자 총 4회 현장 조사에서 채수한 물골 지하수 시료를 대상으로 실험실 내에서 현장 수온과 유사한 조건(~15℃)으로 광노출 실험(800 lux 또는 8000 lux)을 수행하였다.
2020년 5월, 6월, 8월, 11월 광노출 실험에서 측정된 질소화합물 중 질산염이 90% 이상을 차지하였으며, 암모니아와 아질산염은 상대적으로 매우 낮은 농도로 나타났다(Figs. 2, 3). 그래서 물골 지하수 내에는 용존 무기 질소 중 질산염이 가장 많은 질소화합물로 여겨진다. 2020년 5월에 측정된 질산염은 배양 3일~6일에 평균 86.3 mg L–1에서 54.2 mg L–1로 급격하게 감소하다가 배양 9일에는 평균 51.1 mg L–1로 감소 폭이 줄어들었다(Fig. 2). 배양 3일~6일에 측정된 생물학적 변수들을 보면 엽록소-a가 배양 3일(0.05 µg L–1)에 비해 배양 6일(0.10 µg L–1)에 평균 약 2배 정도 증가하였고, 종속영양 박테리아 개체수는 약 9배 정도 증가하였다(Fig. 2). 배양 9일에는 배양 6일에 비해 엽록소-a는 감소하였지만, 종속영양 박테리아는 2배 증가하였다(Fig. 2). 배양 9일~12일에 질산염과 종속영양 미소편모류의 개체수가 급격히 증가하고 종속영양 박테리아가 급격히 감소하였다(Fig. 2).
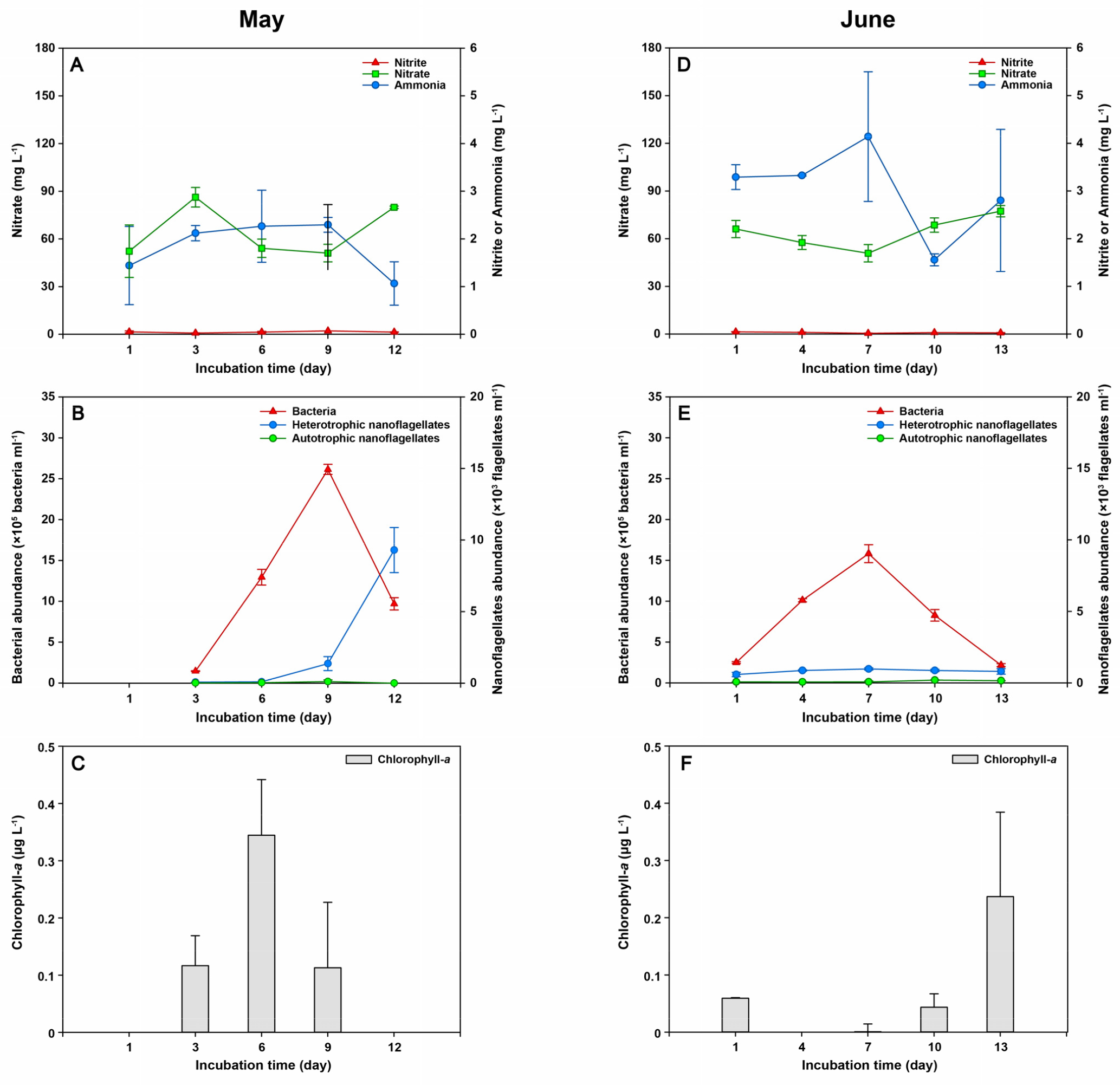
Fig. 2.
Effects of the light intensity (May: 800 lux, June: 8000 lux) on the fluctuations of inorganic nitrogen components (ammonia, nitrate, and nitrate), chlorophyll-a concentration, bacterial abundance, and heterotrophic and autotrophic nanoflagellates abundance in May (A, B, and C) and June (D, E, and F) 2020.
2020년 6월, 8월, 11월 광노출 실험에서 질산염과 미생물과의 관계는 계절에 따라 다소 차이가 있지만, 모든 배양 실험에서 광노출에 따라 엽록소-a가 증가하는 경향은 나타나지 않았으며, 모든 시료의 배양 전 기간에 걸쳐 엽록소-a의 값은 모두 <0.5 µg L–1로 매우 낮았다(Figs. 2, 3). 2020년 5월과 6월 광노출 실험에서 측정된 종속영양 박테리아와 질산염 간의 회귀 분석 결과는 종속영양 박테리아가 증가할수록 질산염이 감소하는 음의 상관관계를 보였지만(R=–0.762, p<0.05, Fig. 4), 2020년 8월과 11월 광노출 실험에서는 두 변수 간에 통계적으로 유의한 상관관계를 보이지 않았다.
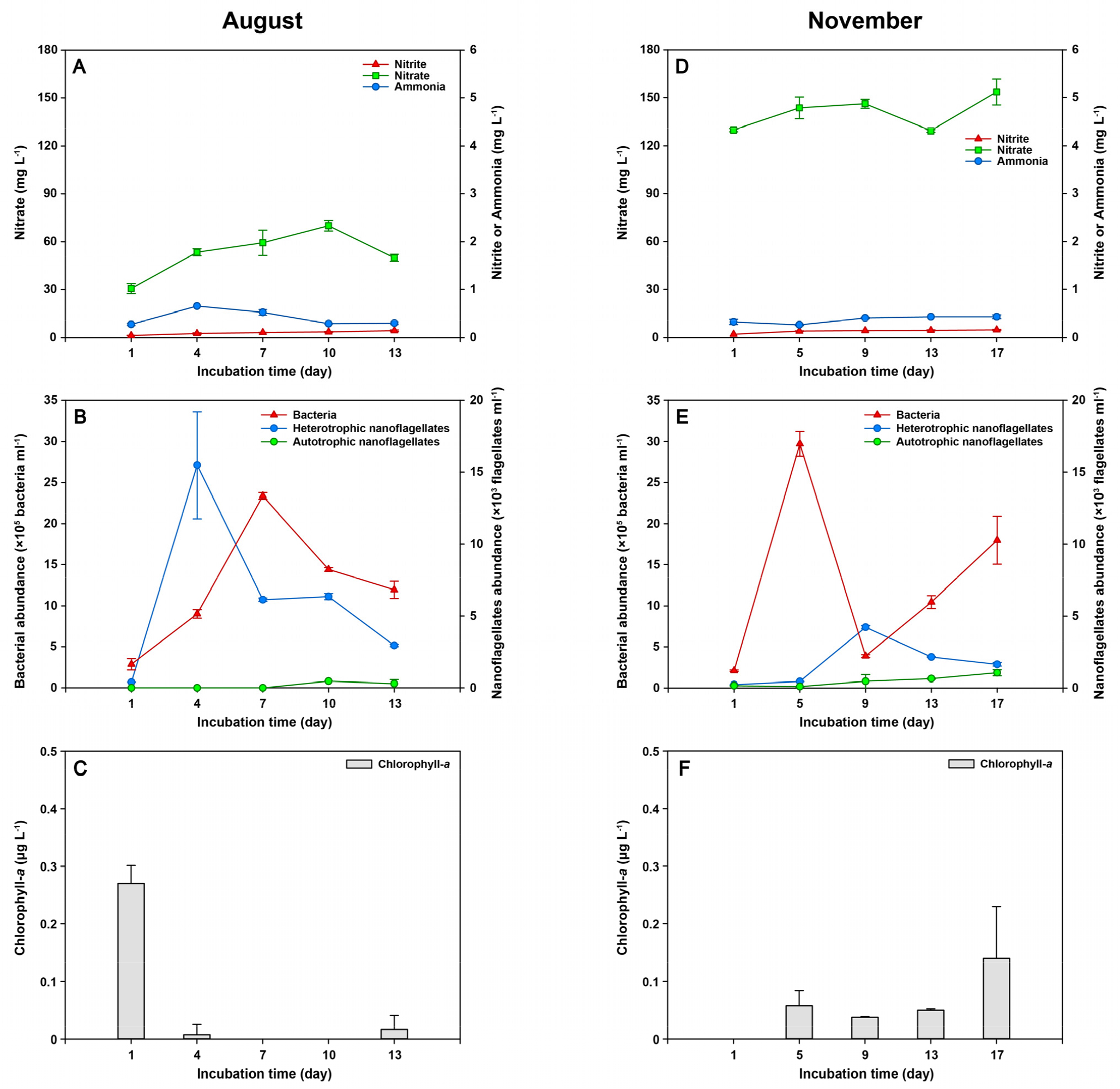
Fig. 3.
Effects of the light intensity (8000 lux) on the fluctuations of inorganic nitrogen components (ammonia, nitrate, and nitrate), chlorophyll-a concentration, bacterial abundance, and heterotrophic and autotrophic nanoflagellates abundance in August (A, B, and C) and November (D, E, and F) 2020.
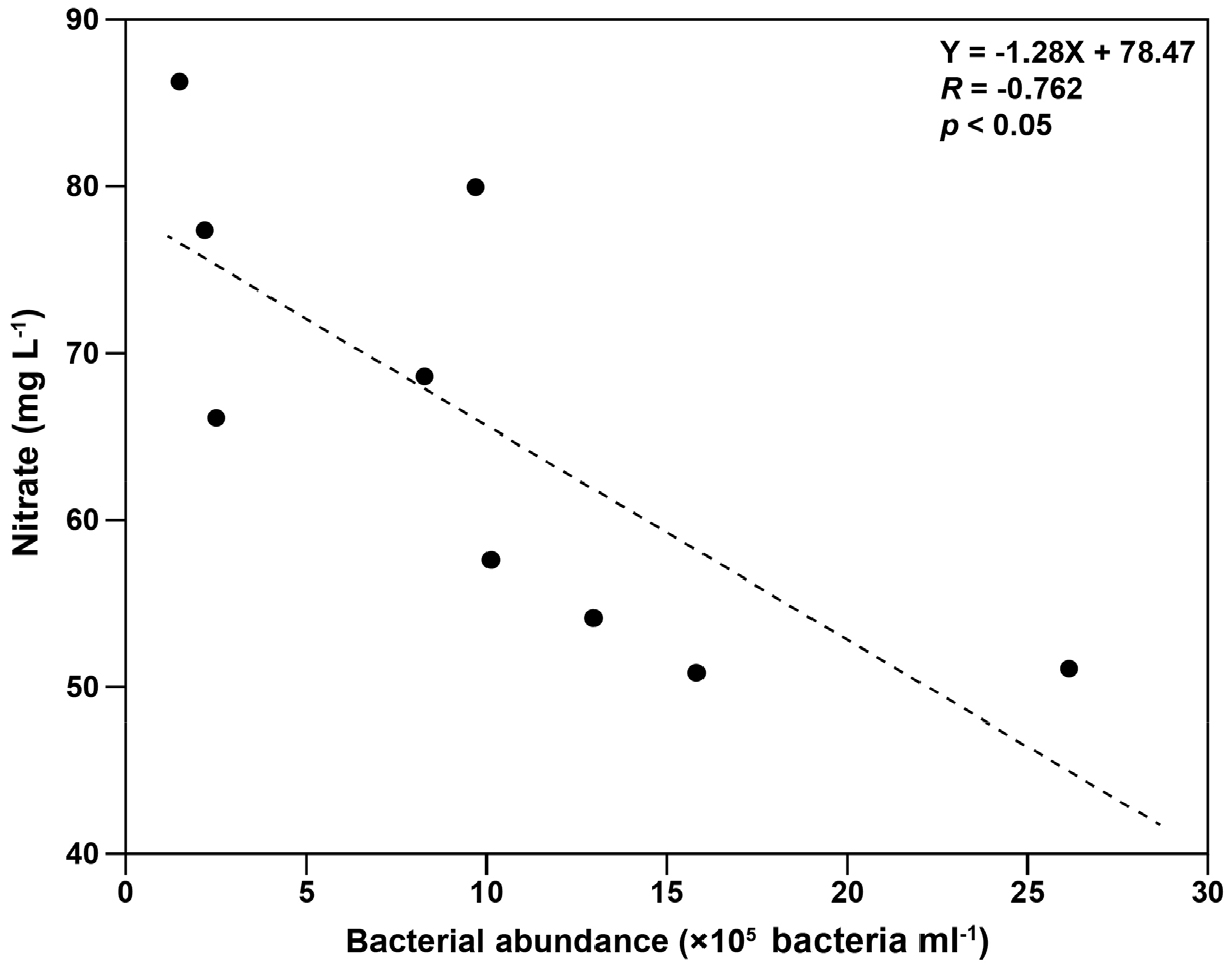
Fig. 4.
Relationship between bacterial abundance and nitrate concentration. Note that a time-series data set was obtained from the light exposure experiments in May and June 2020 (See Fig. 2).
4. 고 찰
4.1 물골 지하수의 수질 특성
2007년 이전까지 독도 물골의 지하수는 덮개로 덮여 있지 않아 자연적인 빛의 투과가 가능하였지만 2007년 이후는 바닷새의 사체 및 배설물 등의 유입을 막기 위해 물골 저수조에 덮개를 덮어 인위적으로 빛의 투과를 차단하였다(Park, 2016; Park, 2017; Choi and Park, 2020). 빛의 차단은 물골 지하수의 저수조에 광합성 생물의 생물량을 낮은 상태로 이끌어 바닷새 배설물 등에서 유래한 영양분이 소비되지 않고 물골 내에서 높은 영양분 상태로 유지되는 것으로 추정된다. 조 등(2011)에 따르면 물골이 위치한 서도는 토양층이 20 cm내외의 매우 얇은 상태를 유지하고 있어 지하수의 기원인 강수가 토양층에 많이 존재하지 않을 것으로 판단된다. 결국, 독도 서도의 경사가 매우 가파른 30° 내외이고 지하수 충전지역이 넓지 않음을 고려할 때 지하수는 빠르게 물골 저수조에 모이고, 강수량에 따라 물골 수질은 크게 변화한다고 볼 수 있다. 2010년 국토해양부 조사에 따르면 독도 물골 지하수는 본 조사와 유사하게 소량의 염분을 포함하고(1.4~2.4 psu), 용존 무기 질소의 함량이 34.7~41.9 mg L–1 범위였으며, 용존 무기 질소의 성분 중 질산염이 대부분을 차지하였다(국토해양부, 2010). 더불어 김 등(2003)이 제주도 염지하수에서 측정한 수질에서도 역시 질산염이 용존 무기 질소 중 90% 이상 차지하였다. 2007년 이전, 덮개로 덮여 있지 않았던 독도 물골의 지하수는 Shin et al.(2003)의 독도 물골 지하수의 연구에서 2003년 8월 엽록소-a 농도가 0.3 µg L–1로 본 연구 조사 결과와 유사하게 매우 낮은 엽록소-a 농도를 보였다. Shin et al.(2003)에 따르면 독도 물골 지하수의 질소화합물 중 암모니아가 78.2% (76.6 µg L–1)를 차지하였고, 전체 질소화합물(암모니아, 아질산염, 질산염)의 농도가 98 µg L–1로 측정되었다. 하지만 질소화합물 중 질산염이 대부분을 차지하는 본 연구와 국토해양부(2010) 결과들과는 차이가 있었고, 더불어 본 연구 및 국토해양부(2010)의 전체 질소화합물의 농도는 Shin et al.(2003)의 측정값에 비해 300배 이상 높게 측정되었다. 본 연구 배양 실험에서 측정된 높은 질산염의 농도는 대기에서 공급되는 질산염이 매우 소량임을 고려할 때 빠른 질산화 작용 및 바닷새에서 유래한 다량의 유기 질소 유입으로 설명될 수 있을 것으로 판단된다(이와 최, 2010). 특히 바닷새 배설물의 질소는 약 80% 요소, 10% 단백질, 7% 암모니아, 0.5% 질산염으로 구성되어 있고, 요소는 암모니아 형태로 변하여 공기 중으로 날아가거나 변형된 암모니아가 콜로이드 형태의 입자에 부착된다(Gillham, 1960; Lindeboom, 1984; Mizutani et al., 1991; Gaskell and Smith, 2007; Szpak et al., 2012). 그래서 원래의 암모니아와 요소에서 변형된 암모니아가 빠른 질산화 과정을 통해서 질산염으로 변형되었을 것으로 사료된다. 일반적으로 질산염은 지하로 침투되는 동안 주변 물질에 흡착되거나 침전하지 않기 때문에 오염된 지역의 지하수에서는 높은 농도로 존재할 수도 있다(Wild, 1981). 특히 독도 바닷새의 분포(주로 괭이갈매기, 바다제비)가 2007년~2017년까지 독도 주변에서 매년 10,000개체 이상 관찰되기 때문에 높은 질산염 농도는 주로 바닷새에서 기인한 것으로 여겨진다(경북대학교 울릉도·독도연구소, 2017). 더불어 독도 물골 저수조의 덮개 설치 이전 연구(Shin et al., 2003)와 본 연구를 포함한 이후 연구에서 질소화합물 구성 성분의 차이는 아마도 미생물 군집 구조의 변화와 관련이 있는 것으로 여겨지며, 향후 이에 대한 면밀한 검토가 필요해 보인다. 결론적으로 본 연구에서 수행된 독도 물골 지하수의 수질 결과를 고려할 때 물골 지하수는 소량의 염분이 있는 기수지역이고, 질산염 농도가 매우 높으며, 엽록소-a 농도가 낮은 환경이라 할 수 있다. 독도 물골 지하수 내에 지속적으로 발생할 수 있는 질소화합물 오염에 대한 체계적이고 과학적인 대책 수립이 필요하다.
4.2 광노출 실험의 고찰
2007년 이후 덮개 설치로 인한 독도 물골 내 빛이 거의 없는 조건에서 식물플랑크톤의 생물량은 매우 낮고, 질소 순환(특히, 질산염)에 종속영양 박테리아가 기여할 것으로 예측되었으며, 800 lux 또는 8000 lux의 광노출 시 일부 시료에서 독립영양 미소편모류가 증가하였지만 매우 낮은 개체수를 보였다. 2020년 5월 실험에서 상대적으로 낮은 노출 광량(800 lux) 때문에 화학적 또는 생물학적 변수가 다소 과소평가 될 수도 있지만, 모든 배양 실험을 진행하는 동안 엽록소-a는 농도 변화 폭이 모두 <0.5 µg L–1로 낮은 값을 보였다. 이는 광량 증가에 따라 식물플랑크톤 생물량의 증가가 유도되지 않았음을 시사하며, 물골은 빛이 거의 없는 환경이기 때문에 현장 시료 내 식물플랑크톤의 생물량이 매우 적어 12~17일간의 광노출 실험 기간에도 불구하고 생물량 증가로 나타나지 않은 것으로 여겨진다.
일반적으로 질소화합물 중 질산염은 종속영양 박테리아의 성장을 위한 선호도가 낮은 질소원이며, 종속영양 박테리아의 성장에 필요한 질소 중 >90%이 암모니아와 아미노산으로 알려져 있다(Wheeler and Kirchman, 1986; Kirchman et al., 1992). 하지만 일반적으로 해양에서 종속영양 박테리아가 전체 질산염 흡수의 평균 28~32%를 담당하는 것으로 보고되었고(Kirchman and Wheeler, 1998; Allen et al., 2002), 특히 질산염이 매우 높은 농도(>650 µM: >40 mg L–1)에서 종속영양 박테리아가 매우 활발하게 질산염을 흡수할 가능성을 제시하였다(Nedwell et al., 1999; Middelburg and Nieuwenhuize, 2000). 본 연구에서도 질산염의 증감은 계절에 따라 종속영양 박테리아 증감과 연관이 있는 것으로 여겨진다(Figs. 2, 4). Wang et al.(2019)의 Halomonas venusta, Yakimov et al.(1998)의 Alcanivorax borkumensis를 포함한 기존 발표된 10종의 호기성 질산화 박테리아와 호기성 탈질산화 박테리아가 현재까지 다양한 물골 시료에서 분리되었고, 물골에서 이들 박테리아가 서식하며 질소 순환에 기여하는 것으로 판단된다. 더불어 엽록소-a 농도가 높으면(>2 µg L–1) 질산염이 주로 식물플랑크톤에 의해 흡수되고, 엽록소-a 농도가 낮으면(<2 µg L–1) 질산염이 주로 종속영양 박테리아에 의해 흡수된다(Fouilland et al., 2007; Trottet et al., 2016). 본 조사에서는 방사성 표지기법(15N)을 활용하여 직접 종속영양 박테리아의 질산염 흡수율을 측정하지 않았지만, 독도 물골의 엽록소-a 농도가 <0.5 µg L–1임을 고려하면 독도 물골 내 질산염의 감소는 주로 종속영양 박테리아의 흡수에 의한 결과로 판단된다. 하지만 독도 물골 내 종속영양 박테리아 개체수는 독도 주변 해역의 종속영양 박테리아 개체수(0.1~0.2 ×106 cells ml–1, 최와 조, 1998)보다 대략 10배 정도 낮게 측정되었기 때문에 실제 현장에서 질산염의 흡수는 독도 주변 해역보다 매우 낮을 것으로 추정된다. 독도 물골은 과학적으로도 매우 흥미로운 지역으로 향후 질산염과 미생물의 관계에 대한 보다 면밀한 규명이 필요하다.
종속영양 미소편모류는 주된 박테리아 섭식자로서 전체 원핵생물의 사망률에 53~61% 기여하고, 질소와 인 순환에 있어서 매우 중요하다(Fuhrman and Noble, 1995; Pedrós-Alió et al., 2000). 2020년 11월 시료의 광노출 실험에서 배양 5일~9일에서 박테리아 개체수가 감소하고 종속영양 미소편모류가 증가할 때 암모니아 농도가 다소 증가하는데, 이는 박테리아를 섭식한 종속영양 미소편모류가 성장에 요구되지 않은 일부 암모니아를 물골 내로 배출한 것으로 추정된다(Sherr et al., 1983; Nagata and Kirchman, 1991). 결국 물골 내 종속영양 미소편모류 역시 물골 질소 순환에 영향을 준다고 할 수 있다.
4.3 독도 물골 수질 개선을 위한 제언
독도 물골은 주변 해무의 영향을 받는 기수지역이자 매우 높은 질산염 농도와 낮은 엽록소-a 농도로 학문적으로 연구할 가치가 매우 높은 지역이며, 1953년~1956년까지 독도의용수비대의 음용수로 활용되었던 독도 물골의 식수원으로의 회복은 영유권 강화에도 매우 중요하다. 더불어 물골 내 질산염 농도 변화를 이끌 수 있는 미생물학적 상호 작용이 현재는 미비한 것으로 판단되어 물골 천연 환경의 보존을 위해 물의 흐름을 원활하게 하여 건강한 생태계로 회복하고 이에 대한 지속적인 모니터링이 필요하다.