1. 서 론
2. 재료 및 방법
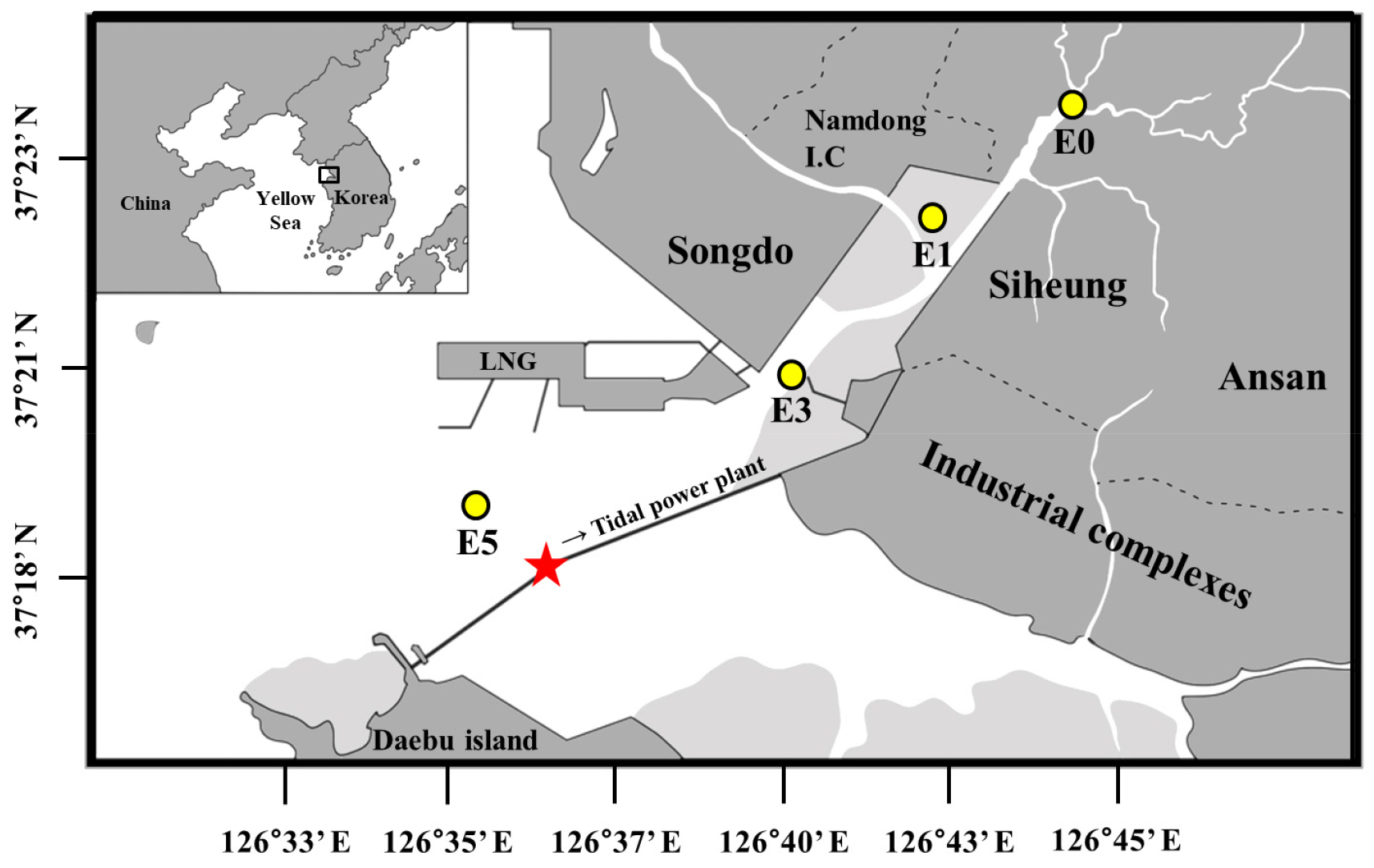
2.1 연구지역
2.2 시료채집
2.3 수층 분석
2.4 퇴적물 내 지화학 성분
2.5 혐기성 유기물 분해율 및 황산염 환원율
2.6 저층 영양염 용출률
3. 결 과
3.1 환경요인
3.2 공극수 내 지화학 성분
3.3 혐기성 유기물 분해율 및 황산염 환원율
3.4 저층 영양염 용출률
4. 토 의
4.1 시화호 인근 연안 퇴적물의 지화학 특성
4.2 혐기성 유기물 분해 및 황산염 환원
4.3 퇴적물로부터 용출된 영양염류가 수층생산력에 미치는 잠재적 영향
4.4 시화호 방조제 건설과 조력발전에 의한 환경영향
1. 서 론
우리나라는 1946년부터 2011년까지 약 231,624 ha에 달하는 국토가 간척을 통해 확장되었다(GRI, 2007). 이는 강화도(30,240 ha)의 약 7.7배, 그리고 제주도(184,700 ha)의 약 1.3배에 달하는 규모이며, 우리나라에 분포된 갯벌(280,000 ha; Koh, 2001)의 약 80%가 매립된 것과 유사한 수치이다. 이러한 간척사업에 의한 영토확장은 주로 농업용지 활용의 목적(70%)과 기타 산업, 주거, 관광 및 휴식의 목적(30%)으로 활용되었으나, 오늘날에는 신공항 건설, 공업단지 조성 및 수도권 인구 분산을 위한 신도시 조성 등의 목적으로 지역과 시대적 상황에 따라 변화하고 있다(GRI, 2007). 이러한 인위적인 연안개발은 지형변화, 성층강화, 퇴적물 축적 등의 해양환경변화를 초래할 뿐만 아니라 정화 능력을 포함하는 갯벌 생태 및 생지화학적 기능의 손실을 가져온다(Han and Park, 1999; Hyun et al., 2004; Jin et al., 2013; Kim et al., 2017). 따라서 연안개발로 인한 연안생태계 훼손은 육상으로부터 유입된 유기물 및 오염물질이 일차적으로 분해되지 않고 직접 외해로 유입되어 수층 뿐만 아니라 저층 퇴적물의 오염을 가속화시켜, 결국 해양 생태계의 변화를 초래할 수 있다.
한반도 서해 중부에 위치한 경기만은 대조차 환경의 조석 작용으로 인해 넓은 면적의 갯벌이 형성되어 높은 생산력과 생물다양성을 나타내는 환경이다(Koh, 2001; MOF, 2004). 또한, 서해 갯벌은 다양한 생물 종들 사이에 복잡하게 얽힌 먹이사슬로 인해 탄소의 순환이 빠르게 진행되며, 이러한 과정들을 통해 육상으로부터 유입된 유기물 및 오염물질을 분해하여 생태적 건강성을 유지시키는 등 중요한 지역으로 인식되어 진다(Koh, 2001; Hyun et al., 2009). 그러나 드넓고 완만한 지형적 조건으로 인해 대규모 매립, 간척사업의 결과로 방조제, 발전소, 항만, 신공항 건설 및 공업단지가 조성되었다(KEI, 2005). 특히, 시화호 인근 연안해역은 농업용지 확보, 산업단지 및 신도시 조성 등의 목적으로 지속적인 간척이 진행되어 왔으며, 인근 소래포구와 오이도 육상지역 및 하수처리장을 통해 고농도의 유기물과 영양염이 유입되고 있다(KWRC, 1998; MOF, 1998). 이러한 유기물 부하가 높은 연안 퇴적물에서 산소는 표층 퇴적물 수 mm이내에서 급격히 고갈되어 호기성 및 준호기성 유기물 분해(탈질소화, 망간 환원, 철 환원) 대신 혐기성 유기물 분해인 황산염 환원에 의해 유기물 분해가 주도된다(Canfield et al., 2005). 황산염 환원 결과로 발생된 황화수소는 강한 독성으로 저서생물 다양성을 감소시킨다(Gray et al., 2002). 한편, 유기물 분해에 의해 유리된 영양염류는 수층으로 확산되어 일차생산에 상당부분 기여(benthic-pelagic coupling)되는 반면, 과도한 영양염류의 공급은 부영양화뿐만 아니라 유해 조류의 대증식을 유발한다(Boynton and Kemp, 1985; Hyun et al., 2013; Matos et al., 2016).
연안 개발로 인한 해양 환경변화를 진단하고, 이에 대한 개선방안을 마련하기 위해서는 퇴적물에서의 유기물 분해, 분해경로 및 저층 영양염 용출이 연안 생태계에 미치는 영향과 같은 생지화학적 과정에 대한 연구가 필수적으로 이루어져야 한다. 최근까지 시화호 인근 연안 해양에서 수행된 연구는 시화호 내측과의 비교를 위한 동물플랑크톤(Park and Huh, 1997) 및 저서동물 군집(Kim and Kwon, 2004; Jung et al., 2012) 조사, 퇴적물 내 미량금속 농도변화(Lee et al., 1998; Ra et al., 2013)와 같은 생물종 분포특성과 화학농도 조사에 관한 연구만 이루어 졌으며, 유기물 분해와 관련된 생지화학 물질순환 연구는 미흡한 실정이다. 본 연구의 목적은 시화호 인근 연안 해양에서, (1) 퇴적물 내 공극수의 지화학 성분 분포특성과 (2) 퇴적물의 총 혐기성 유기물 분해와 황산염 환원의 공간적 변화와 이를 조절하는 요인 그리고, (3) 유기물 분해결과 수층으로 용출된 영양염이 잠재적으로 일차생산을 지지할 수 있는 정도(benthic-pelagic coupling)를 파악하는 것이다.
2. 재료 및 방법
2.1 연구지역
본 연구를 위한 시료 채집은 2015년 7월에 이루어졌으며, 연구 정점은 소래포구 인근 정점(E0), 송도 갯벌 정점(E1), 오이도 선착장 부근 정점(E3), 시화 조력발전소 수문 앞 정점(E5)으로 선정하였다(Fig. 1). 소래포구 인근 정점과 송도 갯벌 정점은 인근 지천을 통해 담수가 유입되어 염분 변화가 큰 지역이고(KWRC, 2001), 시화 조력발전소 수문 앞 정점은 조력발전 가동에 의해 강한 유속이 발생되는 지역이다(Fig. 1).
2.2 시료채집
저층 해수는 니스킨 채수기로 채수한 후, 각 항목에 따라 전처리하였다. 저층수 영양염류(암모니아, 질산염, 인산염)는 현장에서 유리섬유 여과지(Whatman, CA, 0.7 μm)로 여과한 후 분석전까지 냉동(-20℃) 보관하였다. 엽록소-a는 현장에서 500 ml의 해수를 유리섬유 여과지(Whatman, CA, 0.7 μm)로 여과한 후, 10 ml 유리병에 담아 알루미늄 포일로 차광하여 분석전까지 냉동(-20℃) 보관하였다. 퇴적물 시료는 교란을 최소화 하기 위해 잠수부를 이용하여 채취하였으며 퇴적물의 공극수 내 지화학 성분 분석을 위해 내경 6.5 cm, 길이 25 cm의 아크릴 코어를 이용하여 채집하였다. 혐기성 유기물 분해율과 황산염 환원율 측정을 위한 퇴적물 시료는 각각 내경 10 cm, 길이 25 cm와 내경 3 cm, 길이 35 cm의 아크릴 코어를 이용하여 퇴적물을 채집하였다. 영양염 용출률 측정을 위한 퇴적물 시료는 내경 10 cm, 길이 23 cm의 아크릴 코어를 이용하여 퇴적물을 채집하였다. 모든 퇴적물 시료는 현장에서 냉장 보관하여 실험실로 운반하였다.
2.3 수층 분석
투명도는 직경 30 cm의 투명도판(secchi disc)을 이용하여 선상에서 육안으로 측정하였다. 수층 영양염류 분석은 영양염 자동분석기(QUAATRO, Seal Analysis)를 이용하였다. 엽록소-a는 90% 아세톤을 넣어 교반시킨 다음 냉장상태로 24시간 추출 후 흡광광도계(Shimadzu, UV-2401PC)를 이용하여 분석하였다(Parsons et al., 1984). 식물플랑크톤의 일차생산력 측정하기 위해, CO2를 추격자로 이용하는 14C 기법(Steemann-Nielsen, 1952)을 이용하여 광합율(P)과 광도(I)의 함수를 구하였다. 각 정점에서 채집한 표층 해수를 1 L 갈색 시약 병에 넣고, 14C(NaH14CO3) (Perkin Elmer Inc.)를 주입하여 잘 섞은 후 일련의 광구배(5–100%)가 되어있는 배양플라스크에 나누어 담은 후 ICES incubator (Hydro-Bios, Germany)에서 2시간 배양하였고(Colijn and Edler, 2002), 플라스크의 광량은 스칼라 피복사도 측정기(Biospheriacal instruments Inc., QSL-2100)를 이용하여 측정하였다. 수온은 순환온도 조절기(Lklabkorea Inc., LC-LT230)를 사용하여 현장 수온을 유지하였다. 배양이 끝나면 즉시 유리섬유 여과지(Whatman, CA, 0.7 μm)로 여과한 뒤 여과지를 섬광용기병에 담고, 3 N HCl 1 ml을 넣어 24시간 훈증(Huming)하여 무기탄소를 제거하였다. 훈증이 끝난 시료는 섬광액(Scintillation cocktail; Ultima gold, Perkin Elmer Inc.)을 10 ml 넣어 냉암소에 2–3일 보관한 후 액체섬광계수기(Liquid Scintillation Counter; LSC, Tri-carb 2910 TR; Perkin Elmer, Waltham, USA)로 분당 붕괴수(dpm)를 측정하였다. 분당 붕괴수는 식물플랑크톤이 고정한 탄소량으로 환산하여 일차생산력 계산에 이용하였다.
2.4 퇴적물 내 지화학 성분
퇴적물의 밀도와 공극률은 퇴적물의 부피와 건조 전, 후 무게로부터 계산하였다(Mortimer et al., 1998). 표층 퇴적물(0-2 cm)의 엽록소-a는 끝을 자른 주사기로 퇴적물 1 ml을 취하여 90% 아세톤을 넣어 준 다음 냉장상태로 24시간 추출 후 흡광광도계(Shimadzu, UV-2401 PC)를 이용하여 분석하였다(Parsons et al., 1984). 표층 퇴적물(0-2 cm) 내 총 유기탄소(total organic carbon; TOC)와 총 질소(total nitrogen; TN)함량은 퇴적물을 동결건조 시킨 후 마노 사발(agate mortar)로 분말화시킨 다음 1 N HCl로 무기탄소(inorganic carbon)를 제거한 후 주석 용기(tin cap)에 담아 CHNS 원소 분석기(GV Instruments, EA1110)로 분석하였다. 공극수 내 지화학 성분 분석을 위해 퇴적물을 질소가스로 충진 된 혐기성 박스 안에서 깊이 별로 원심분리관에 담고 원심분리(3,500 rpm, 10분)시킨 후 다시 혐기성 박스 안에서 공극수를 취하여 주사기 여과지(MFS-25, CA, 0.2 μm)로 부유물을 제거시킨 다음 공극수를 채취하였다. 공극수 암모니아는 퇴적물에서 추출한 공극수 일정량을 2 ml 유리병에 옮긴 후 20 ㎕의 포화된 염화수은(HgCl2, 125 mM)을 넣어준 후 FIA (flow injection analysis) 방법을 이용하여 측정하였다(검출한계: 5 μM; Hall and Aller, 1992). 인산염은 영양염 자동분석기(QUAATRO, Seal Analytical)를 이용하여 측정하였다(검출한계: 0.006 μM). 공극수 철(Fe2+)의 농도는 ferrozine buffer (0.02% in 50 mM HEPES, pH 7.0)에 산 처리된 시료를 넣고 10분 동안 200 rpm으로 교반시킨 후 흡광광도계(Shimadzu, UV-2401PC)를 이용하여 측정하였다(검출한계: 0.2 μM; Stookey, 1970). 공극수 내 용존 유기탄소(dissolved organic carbon; DOC)는 퇴적물에서 추출한 공극수 일정량을 주사기 여과지(Whatman, CA, 0.7 μm)로 부유물을 제거시킨 다음 HCl을 첨가하여 무기탄소를 제거한 후 Shimadzu TOC analyzer (VCPH model)를 이용하여 고온연소산화방법으로 측정하였다(검출한계: 0.004 μM; Sugimura and Suzuki, 1988). 총 환원황(total reduced inorganic sulfur; TRIS)의 농도는 single-step chromium reduction 방법(Fossing and Jørgensen, 1989)에 의해 추출된 시료를 Zn-acetate (20%)로 고정 처리한 후 메틸린 블루 방법으로 측정하였다(Cline, 1969)
2.5 혐기성 유기물 분해율 및 황산염 환원율
질소가스로 충진 된 혐기성 박스 안에서 퇴적물을 깊이 별로 자르고, 고르게 섞어 준 후 50 ml 원심분리관에 일정량씩 옮겨 담아 현장 온도 조건 아래 배양하였다(Hyun et al., 2004). 일정시간 간격(0, 1, 2, 3, 5일)으로 튜브를 꺼내어, 원심분리(3,500 rpm, 10분)시킨 후 다시 혐기성 박스 안에서 공극수를 취하여 주사기 여과지(MFS-25, CA, 0.2 μm)로 부유물을 제거한 공극수 시료를 확보하였다. 혐기성 유기물 분해율 산정을 위한 용존 무기탄소(dissolved inorganic carbon; DIC)는 FIA 방법으로 측정하였다(Hall and Aller, 1992).
황산염 환원율 측정은 core injection 방법을 이용하였다(Jørgensen, 1978). 5 μL carrier-free 35SO42-(약 2.5 μCi, Perkin Elmer Inc.)를 미리 실리콘으로 막아놓은 주입구(1 cm 간격)를 통해 주입한 후, 현장온도 조건하의 배양기 안에서 2시간 동안 배양하였다. 배양시간 동안 생성된 환원 황을 고정하기 위해 1–2 cm 간격으로 자른 퇴적물을 zinc acetate (20%) 용액(10 ml)이 담긴 50 ml 원심분리관에 넣고 잘 흔들어준 다음 분석 전까지 냉동(-20℃) 보관하였다. Zinc acetate 용액에 보관된 퇴적물로부터 35S를 추출하기 위해 single-step chromium reduction 방법을 이용하였다(Fossing and Jørgensen, 1989). 추출된 35S는 섬광액을 10 ml 넣어준 후 액체섬광계수기로 계수율(cpm)을 측정한후, 황산염 환원율을 계산하였다.
2.6 저층 영양염 용출률
저층 영양염 용출률(benthic nutrient flux; BNF)은 코어 배양법을 이용하였다(Kim et al., 2017). 측정을 위한 시료 채취는 일정 시간에 따라 코어로 부터 상층수 시료를 취하여 유리섬유 여과지(Whatman, CA, 0.7 μm)로 여과한 후 냉동(-20℃) 보관하였다. 분석 전 해동시킨 후 영양염 자동분석기(QUAATRO, Seal Analytical)를 사용하여 용존 무기 영양염(NH4+, NOx: NO2- + NO3-, PO43-)의 농도를 측정하였다. 퇴적물로부터 용출되는 영양염 용출률은 시간에 따라 변하는 농도를 이용하여 계산하였다.
여기서, F는 저층 용출률(mmol m-2 d-1), dC/dt는 시간에 따른 영양염 농도의 변화, V는 chamber core 부피(m3), A는 chamber core 면적(m2)이다(Lee et al., 2012).
3. 결 과
3.1 환경요인
수심, 투명도 및 저층해수의 염분, 영양염, 엽록소-a 농도와 표층 퇴적물(0-2 cm)의 공극률, 밀도, 엽록소-a, 총 유기탄소, 총 질소 농도를 Table 1에 나타냈다. 수심은 1.8-12.0 m 범위로 나타났고, 정점 E1에서 1.8 m로 가장 낮은 수심을 보인 반면, 조력발전소 수문 앞 정점(E5)에서 12.0 m로 가장 깊은 수심을 보였다. 투명도는 0.3-1.5 m 범위로 나타났으며, 정점 E0에서 0.3 m로 가장 낮게 관측되었고, 외측으로 갈수록 증가되어 정점 E5에서 1.5 m로 가장 높은 투명도를 보였다. 저층수의 염분은 24.6–28.0의 범위로 나타났으며, 소래포구 인근 정점(E0)에서 상대적으로 낮은 염분(24.6)이 관측되었다. 저층수 내 암모니아, 질산염(NOx : NO2- + NO3-) 및 인산염 농도는 각각 7.7–168.6, 5.2–29.9, 0.6–5.3 μM의 범위로 나타났으며, 정점 E0에서 가장 높고, 외측으로 갈수록 감소되는 것으로 나타났다. 저층수 엽록소-a 농도는 0.8–3.0 μg L-1의 범위로 나타났으며, 정점 E0에서 가장 높게 나타났다.
Table 1.
Environmental parameters in the bottom water column and surface sediment (0-2 cm) of Lake Shihwa neighboring coastal waters
퇴적물의 공극률은 0.660–0.744, 밀도는 1.375–1.518 g cm-3의 범위로 나타났다. 퇴적물 표층 2 cm 내의 엽록소-a 양은 121–346 mg m-2의 범위로 나타났다. 퇴적물 표층 2 cm 내의 총 유기탄소 농도는 정점 E0에서 0.913%, 총 질소 농도는 0.101%로 가장 높게 나타났고, 외측으로 갈수록 점차 낮아지는 것으로 나타났다.
3.2 공극수 내 지화학 성분
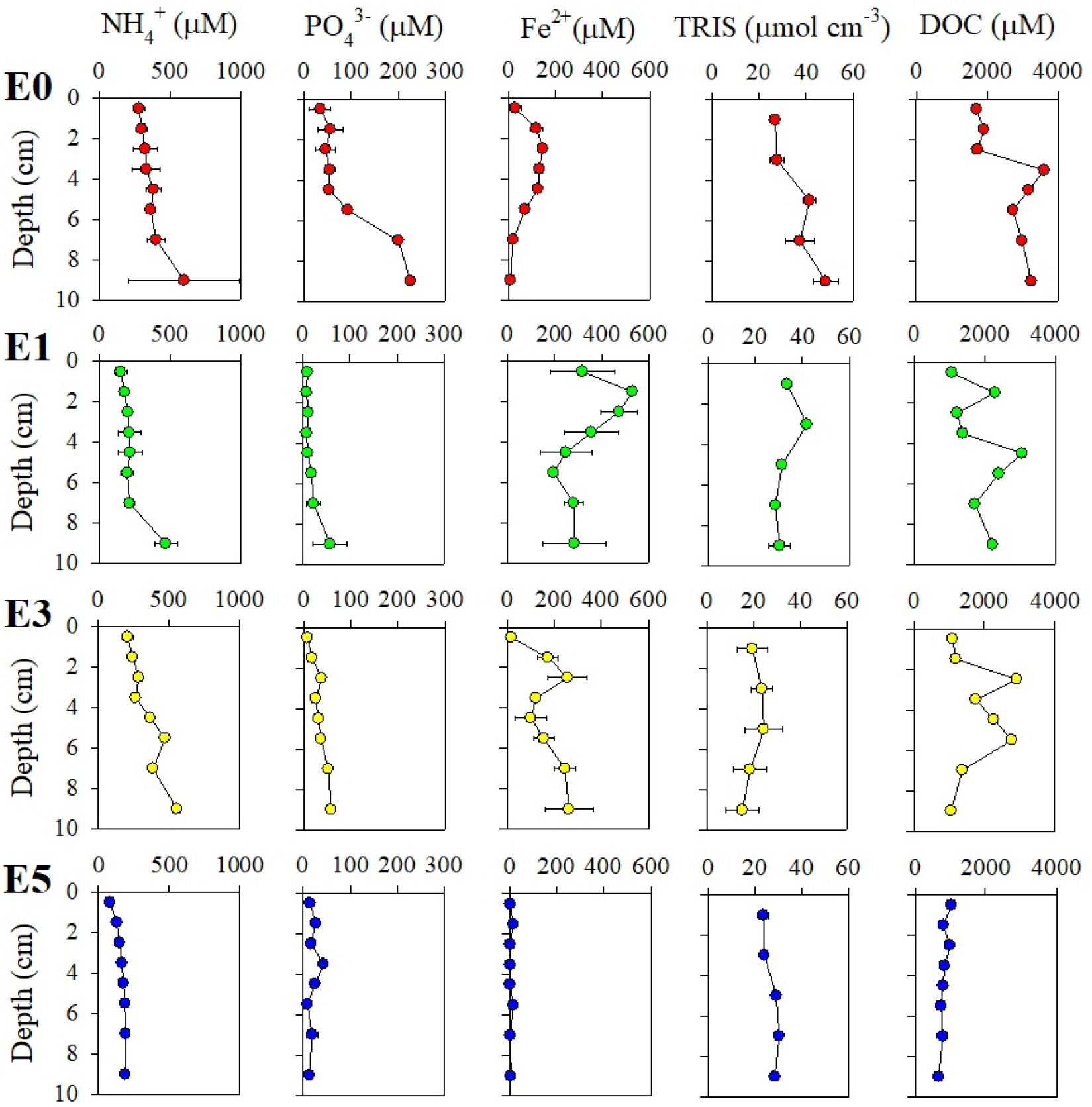
공극수 내 암모니아와 인산염 농도는 각각 79.3–794.9, 7.9–226.1 μM의 범위로 나타났다(Fig. 2). 정점 E0, E1, 및 E3에서 암모니아 농도는 퇴적물 깊이가 증가할수록 퇴적물 내 축적되는 양상으로 나타난 반면, 정점 E5에서는 퇴적물 깊이에 따른 농도의 변화가 미미하였다(Fig. 2). 정점 E1, E3, E5에서 인산염은 퇴적물 깊이에 따라 농도 변화가 일정한 반면, 정점 E0에서 퇴적물 5 cm 깊이 이상에서 급격히 증가하는 것으로 나타났다(Fig. 2). 암모니아와 인산염의 농도를 퇴적물 깊이 10 cm 까지 누적한 결과, 육지와 인접해있는 정점인 E0, E1, E3 (16.2–24.6 mmol N m-2, 1.5–7.3 mmol P m-2)에서 수문 앞 정점 E5 (10.4 mmol N m-2, 1.3 mmol P m-2)보다 최대 2-6배 높게 나타났다(Table 2). 공극수 철의 농도는 0.6–530.0 µM의 범위로 나타났으며, 정점 E5를 제외하고 대부분 정점에서 표층 2–3 cm 내 가장 높은 농도를 보였다(Fig. 2). 공극수 철의 농도를 퇴적물 깊이 10 cm 까지 누적한 결과, 정점 E1에서 20.6 mmol m-2로 가장 높게 나타났으며, 정점 E5에서 0.3 mmol m-2로 가장 낮게 나타났다(Table 2). 퇴적물 내 총 환원 황의 농도는 15.4–48.5 μmol cm-3의 범위로 나타났으며, 정점 E0에서 퇴적 깊이가 증가할수록 축적되는 양상을 보인 반면, 그 외 모든 정점에서 수직적으로 일정한 양상을 보였다(Fig. 2). 총 환원 황의 농도를 퇴적물 깊이 10 cm 까지 누적한 결과, 육지와 인접해있는 정점 E0, E1 (3,314–3,637 mmol m-2)에서 정점 E3, E5 (2,032-2,715 mmol m-2)보다 최대 2배 가량 높게 나타났다(Table 2). 특히, 정점 E0 (3,637 mmol m-2)에서 가장 높았고, 외측으로 갈수록 점차 감소되는 경향으로 나타났다(Table 2). 용존 유기탄소 농도는 674-3,607 μM의 범위로 나타났으며, 육지와 인접해있는 정점(E0, E1, E3)에서 용존 유기탄소는 퇴적물 깊이가 증가할수록 공극수 내 축적되는 양상을 보인 반면, 수문 앞 정점(E5)에서 퇴적물 깊이에 따른 농도변화가 미미하였다(Fig. 2). 용존 유기탄소의 농도를 퇴적물 깊이 10 cm 까지 누적한 결과, 육지와 인접해있는 정점 E0, E1, E3 (107–171 mmol m-2)에서 수문 앞 정점 E5 (53 mmol m-2)보다 최대 3배 높게 나타났으며, 특히, 정점 E0 (171 mmol m-2)에서 가장 높았고, 외측으로 갈수록 점차 감소되는 경향으로 나타났다(Table 2).
Table 2.
Depth integrated (0-10 cm) inventories of ammonium, phosphate, iron, total reduced inorganic sulfur (TRIS), and dissolved organic carbon (DOC) in the pore water and sediment
| Station | NH4+ | PO43- | Fe2+ | TRIS | DOC |
| (mmol m-2) | |||||
| E0 | 24.6 | 7.3 | 4.4 | 3,637 | 171 |
| E1 | 16.2 | 1.5 | 20.6 | 3,314 | 113 |
| E3 | 23.2 | 2.2 | 11.5 | 2,032 | 107 |
| E5 | 10.4 | 1.3 | 0.3 | 2,715 | 53 |
3.3 혐기성 유기물 분해율 및 황산염 환원율
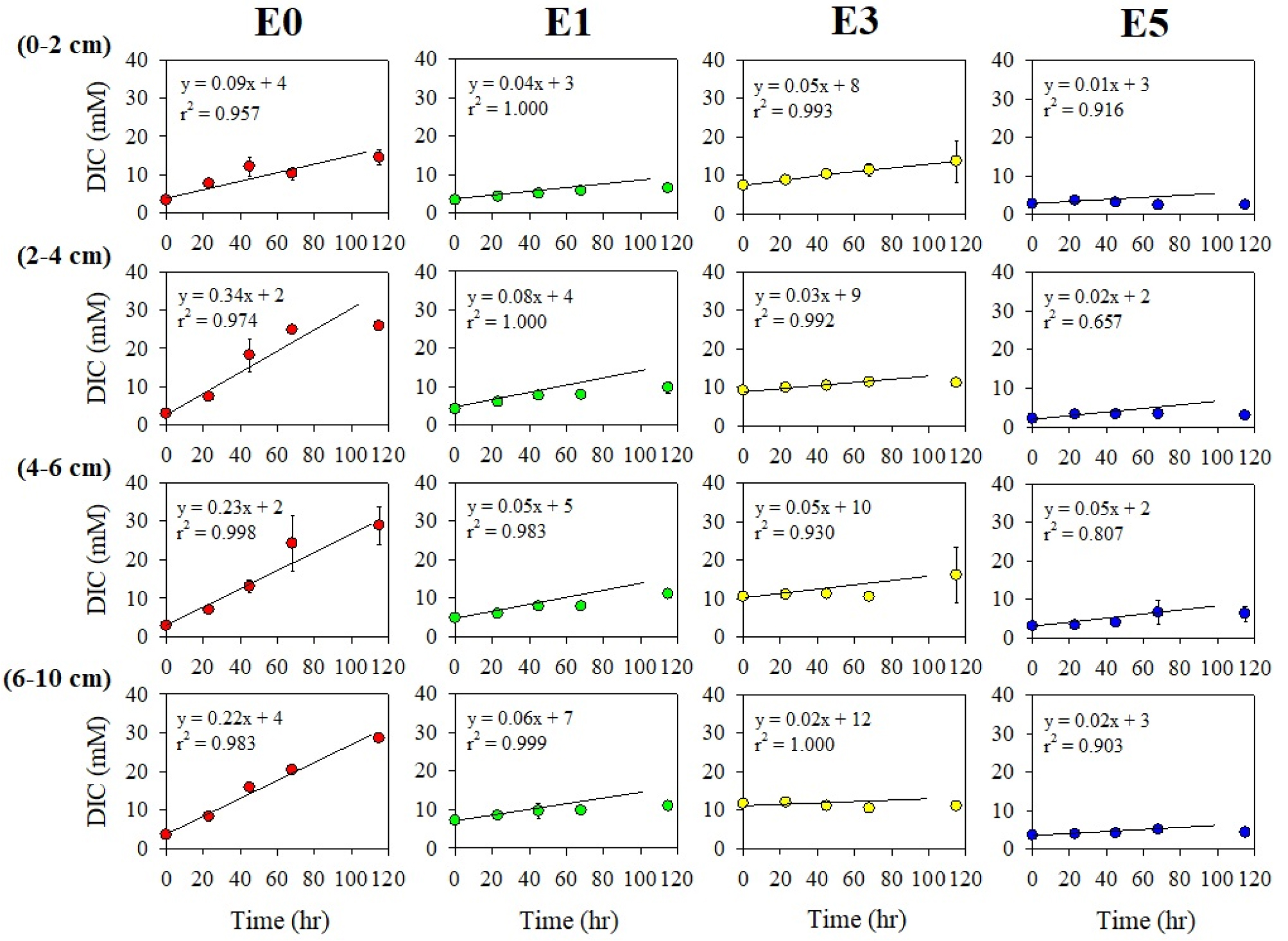
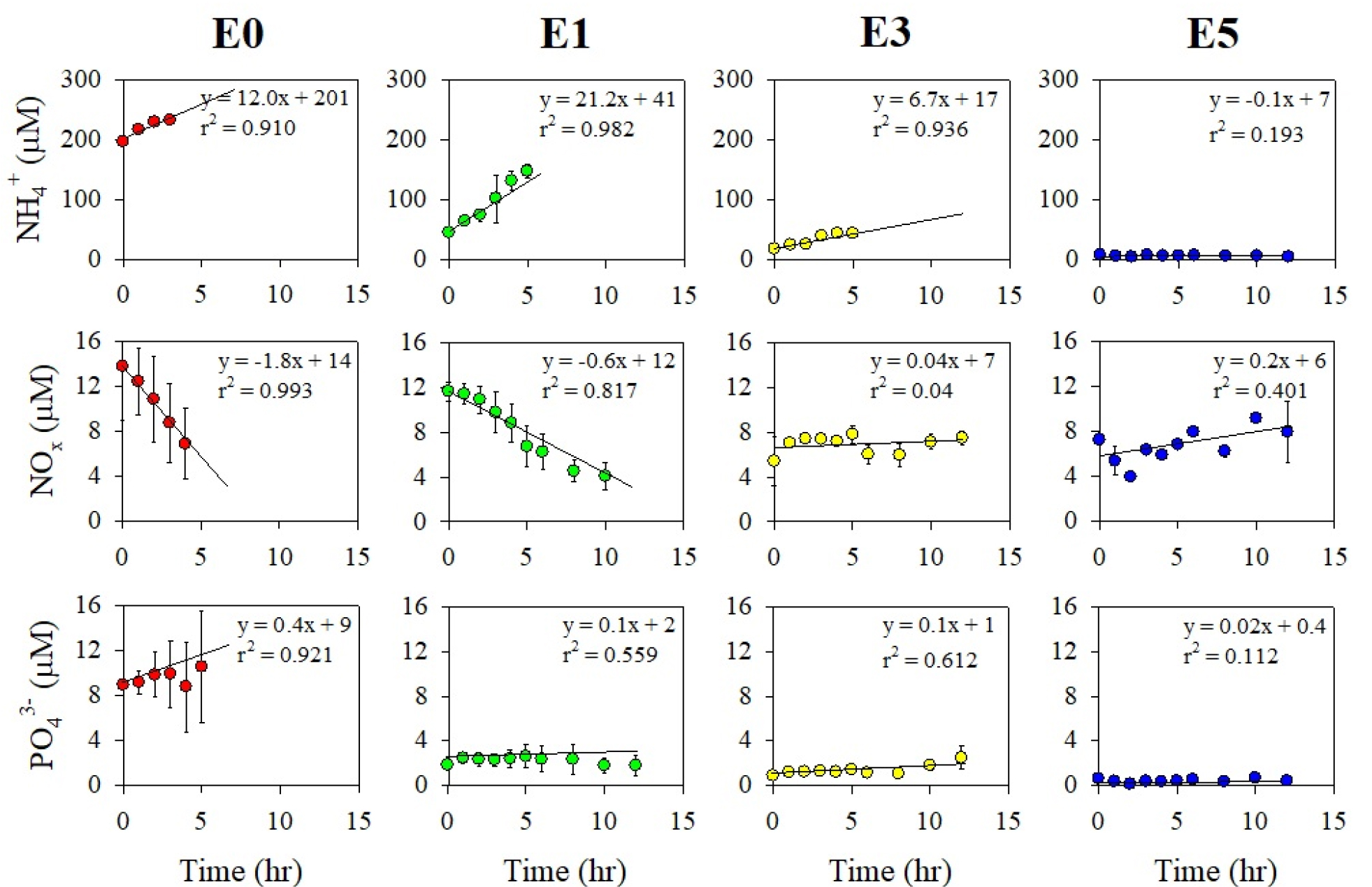
시간에 따른 용존 무기탄소 증가량을 통해 계산된 혐기성 유기물 분해율은 0.009–0.337 mM hr-1의 범위로 나타났다(Fig. 3). 정점 E0과 E1에서 혐기성 유기물 분해율은 각각 0.090–0.337, 0.038–0.078 mM hr-1로 전 층에서 활발히 유기물 분해가 일어나고 있는 반면, 정점 E3은 퇴적물 0–2 cm (0.055 mM hr-1), 정점 E5는 퇴적물 4–6 cm (0.048 mM hr-1)에서 혐기성 유기물 분해가 가장 높게 나타났다(Fig. 3). 혐기성 유기물 분해율을 퇴적물 깊이 0–10 cm 까지 누적한 결과, 정점 E0 (260.6 mmol C m-2 d-1)에서 정점 E5 (30.5 mmol C m-2 d-1) 보다 약 9배 높게 나타났다(Table 3).
Table 3.
Depth intergrated (0-10 cm) rate of Corg oxidation and sulfate reduction (SR), and its contribution to Corg oxidation
aCorg oxidation by sulfate reduction is calculated from the CH3COO- + SO42- + 2H+ = 2CO2 + HS- + 2H2O (Kostka et al., 2002a),
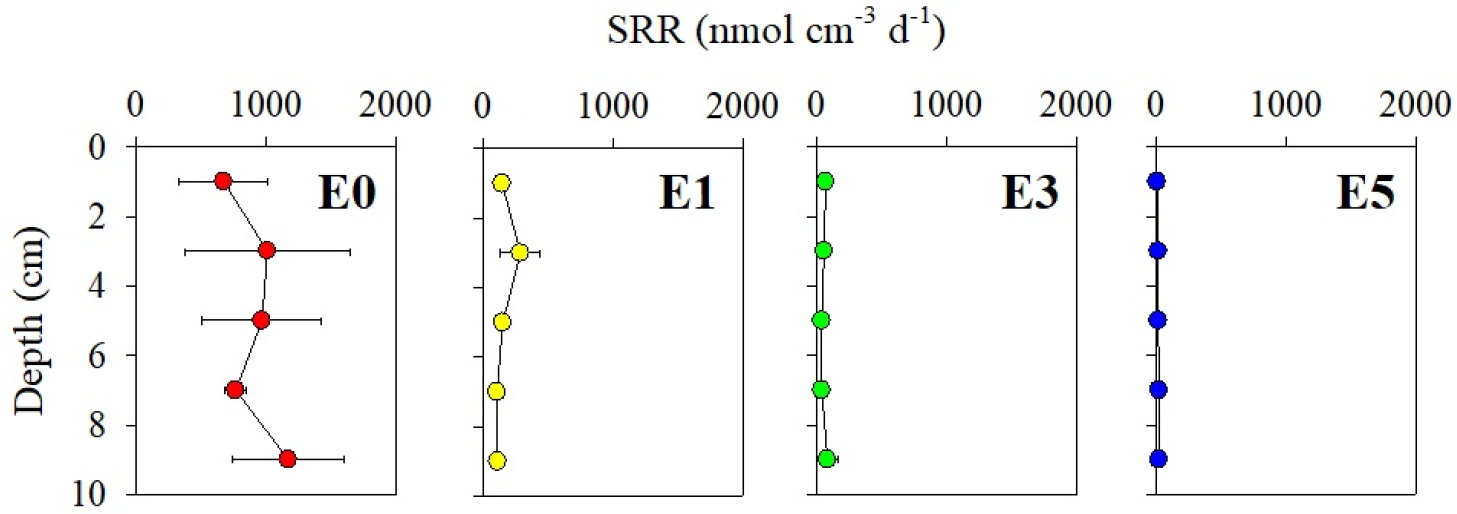
황산염 환원율은 7.8–1166.0 nmol cm-3 d-1의 범위로 나타났다(Fig. 4). 정점 E0에서 환산염 환원율은 퇴적물 깊이가 증가함에 따라 증가하는 양상으로 나타난 반면, 그 외 정점(E1, E3, E5)에서 수직적으로 일정하게 나타났다(Fig. 4). 정점 E0와 E1에서 황산염 환원율은 각각 669.9-1166.0, 104.6-284.7 nmol cm-3 d-1로 전 층에서 활발하게 황산염 환원이 일어나고 있는 반면, 그 외 정점에서는 7.8-81.2 nmol cm-3 d-1의 범위로 상대적으로 낮은 황산염 환원율을 보였다(Fig. 4). 황산염 환원율을 퇴적물 깊이 0–10 cm 까지 누적한 결과, 정점 E0 (91.4 mmol S m-2 d-1)에서 정점 E5 (1.7 mmol S m-2 d-1) 보다 약 54배 높게 나타났다(Table 3).
3.4 저층 영양염 용출률
퇴적물에서의 암모니아, 질산염, 인산염 용출률은 각각 -0.1–21.2, -1.8–0.2, 0.02–0.36 μM hr-1의 범위로 나타났다(Fig. 5). 암모니아와 인산염의 농도는 정점 E5를 제외한 모든 정점에서 시간이 증가함에 따라 증가되는 양상으로 나타났고, 질산염의 농도는 정점 E0와 E1에서 시간이 증가함에 따라 감소되는 양상으로 나타났다(Fig. 5). 특히, 암모니아와 인산염의 용출률은 정점 E0와 E1에서 각각 12.0–21.2, 0.10–0.36 μM hr-1로 상대적으로 높은 용출을 보인 반면, 정점 E3, E5에서는 -0.1-6.7, 0.02-0.09 μM hr-1로 용출이 미미하였다(Fig. 5).
4. 토 의
4.1 시화호 인근 연안 퇴적물의 지화학 특성
수층 영양염(NH4+, NOx, PO43-) 농도는 소래포구 인근 정점 E0에서 가장 높은 농도로 나타났으며, 외측으로 갈수록 희석되어 농도가 감소하는 양상으로 나타났다(Table 1). 시화호 외측에 위치한 조간대 및 조하대 지역은 육지와 바다가 서로 접해있는 ‘반 폐쇄성 해안’으로 특히, 정점 E0와 E1은 도시와 인접해 있어 인간활동의 영향을 직접적으로 받으며, 소래포구 인근 지천(장수천, 신천천, 보통천 등)과 송도 갯벌 인근 지천(승기천, 남동유수지 등)을 통해 영양염과 유기물 유입이 많은 지역이다(KWRC, 1998; MOF, 1998). Jang et al.(2011)의 연구에 따르면 소래포구 인근 수층에서 총 질소(TN)와 총 인(TN)의 농도가 높은 것으로 나타났으며, 공업폐수 중 주 오염물인 놀리페놀화합물 역시 소래포구 인근 정점에서 가장 높은 농도로 나타났다(Choi et al., 2011). Shin and Cho(2001)에 의하면 송도 갯벌로 유입되는 승기천과 남동 유수지는 주변 도시에서 배출된 생활하수와 남동공단에서 배출된 산업폐수로 인해 수질이 악화되었다고 보고하였다. 퇴적물 표층의 총 유기탄소(TOC)와 총 질소(TN) 및 공극수 내 용존 유기탄소(DOC) 농도는 소래포구 인근 정점에서 가장 높게 나타났으며(각 0.913%, 0.101%, 171 mmol m-2), 외측으로 갈수록 희석되어 농도가 감소하는 양상으로 나타났다(Table 1, 2). 퇴적물 공극수 내 환원물질(NH4+, PO43-, TRIS) 또한 소래포구 인근 정점 E0에서 가장 높은 농도로 축적되어 있었으며 이는 소래포구 인근지역이 외측보다 상대적으로 혐기성 환경임을 시사한다(Table 2). 공극수 내의 높은 환원물질 축적은 저서동물의 생리/생태에 악영향을 미치며 종 다양성의 감소 뿐만 아니라 심할 경우 저서동물의 폐사를 야기한다(Diaz and Rosenberg, 1995; Gray et al., 2002). 실제로 Jung et al.(2012)의 연구에 따르면 저서동물의 다양성은 시화호 외측의 상류로 갈수록 감소하는 것으로 나타났다. 결론적으로 소래포구 상류(장수천 신천천 등)와 남동 공단 인근(승기천, 남동 유수지 등)에서의 인간활동이 오염원으로 작용하여 수층 부영양화와 퇴적물의 유기물 축적 및 혐기화를 가속화 시킨 것으로 판단된다.
4.2 혐기성 유기물 분해 및 황산염 환원
연안해양에서 퇴적물 내 혐기성 유기물 분해율은 유기물의 공급량과 성분, 온도, 식생의 유무, 입도, 조석활동 및 저서동물의 활동 등에 의해 조절된다(Holmer, 1996; Kostka et al., 2002a, 2002b). 여러요인 중 유기물의 공급은 유기물 분해율을 조절하는 가장 중요한 요인으로 작용한다(Hyun et al., 2004). 특히, 유기물 분해율은 유기물의 공급량과 성분뿐만 아니라 유기물의 존재형태에 의해 영향을 받는다(Hyun et al., 2003).
혐기성 유기물 분해 중 황산염 환원이 차지하는 비율은 정점 E1, E3, E5에서 50% 이하로 조사된 반면, 소래포구 인근 정점 E0에서는 70%로 조사되었다(Table 3). 산소 투과도가 낮고, 유기물 공급이 많은 연안 퇴적물에서 황산염 환원은 혐기성 유기물 분해의 대부분을 차지하는 것으로 보고되고 있다(Canfield et al., 2005). 혐기성 유기물 분해 중 황산염 환원이 차지하는 비율은 자연 하구갯벌인 강화도 남단 갯벌에서 36-40% (Hyun et al., 2009), 파푸아 뉴기니의 파푸아만에서 44% (Alongi, 1995)로 정점 E1, E3, E5와 유사한 값을 보였다. 그러나 정점 E0에서는 퇴적물 내의 높은 총 유기탄소와 용존 유기탄소 농도(Table 1, 2)로 인해 황산염 환원에 의한 유기물 분해가 주도되는 것으로 판단된다.
시화호 인근 연안 퇴적물에서 유기물 분해율과 유기탄소(TOC, DOC) 간의 상관관계를 나타낸 결과, 혐기성 유기물 분해율과 황산염 환원율은 총 유기탄소(각각 R2 = 0.712, 0.682) 보다 용존 유기탄소(각각 R2 = 0.795, 0.777)와의 상관관계가 더 높게 나타났다(Table 4). 일반적으로 유기물 분해에 관여하는 미생물들은 세포질 막을 통해 작은 크기의 유기물을 체내로 흡수(assimilation)하기 때문에 입자성 유기물들은 일차적으로 용해된 형태로 전환되어야 한다(Alperin et al., 1999). 퇴적물 내 용존 유기탄소는 미생물이 주도하는 가수분해(hydrolysis)과정으로 생성될 수 있으며, 발효과정(fermentation)을 통해 유기화합물 형태로 공극수로 방출되기도 한다(Alperin et al., 1999; Canfield et al., 2005). 이렇게 생성된 용존 유기탄소는 미생물에 의한 유기물 분해 과정을 거쳐 최종적으로 용존 무기탄소로 산화된다(Henrichs, 1993; Alperin et al., 1994). 따라서 시화호 인근 해양 퇴적물 내 유기물 분해에 관여하는 미생물은 입자성 유기탄소보다는 용존 유기탄소를 더 선호하는 것으로 여겨진다. 결론적으로 유기물 유입이 많은 조간대 정점 E0에서 유기물 분해는 유기물 공급량과 존재 형태에 의해 조절되는 것으로 판단된다.
Table 4.
Linear regression between total organic cabon (TOC) and dissolved organic carbon (DOC) and microbial metabolic activities (Corg oxidation and SR)
| R2 | n | |
| TOC vs. Corg oxidation | 0.712 | 4 |
| TOC vs. SR | 0.682 | 4 |
| DOC vs. Corg oxidation | 0.795 | 4 |
| DOC vs. SR | 0.777 | 4 |
4.3 퇴적물로부터 용출된 영양염류가 수층생산력에 미치는 잠재적 영향
본 연구에서 수층 내 식물플랑크톤의 일차 생산력은 62–167 mmol m-2 d-1의 범위로 정점 E0에서 62 mmol m-2 d-1로 가장 낮게 나타났고, 정점 E5에서 167 mmol m-2 d-1로 가장 높게 나타났다(Table 5). Redfield ratio (C:N:P= 106:16:1)를 이용하여 일차생산자가 필요로 하는 영양염의 요구량을 계산한 결과, 용존 무기질소와 용존 무기인은 정점 E0 (9.4 mmol N m-2 d-1, 0.58 mmol P m-2 d-1)에서 가장 낮았고, 외측으로 갈수록 점차 증가되어 정점 E5 (25.2 mmol N m-2 d-1, 1.58 mmol P m-2 d-1)에서 가장 높게 나타났다(Table 5). 일차생산자가 필요로하는 영양염 중 저층 영양염 용출의 기여도는 육지와 인접해 있는 정점(E0, E1, E3)에서 용존 무기질소와 용존 무기인이 각각 120–510%, 26–178%로 일차생산자가 필요로 하는 양보다 과도하게 용출되어 일차생산에 공급되고 있는 것으로 나타났다(Table 5). 반면, 정점 E5 저층에서 용출된 무기질소와 무기인은 최대 각각 1, 3%에 해당되는 양으로 일차생산에 공급되고 있었다(Table 5). Lee et al.(2012)은 천수만 하구둑 부근에서 퇴적물로부터 용출된 무기질소와 무기인은 일차생산자가 필요로 하는 양의 각각 142, 131%를 공급하는 것으로 보고하였다. 또한, 유기물 부하가 극심한 남해 강진만의 어류양식장에서 퇴적물로부터 용출된 무기질소와 무기인은 일차생산자가 필요로 하는 양의 각각 67–217%, 112–390%로 공급하는것으로 나타났다(NFRDI, 2013). 육상오염 물질로부터 영향을 받는 시화호 상류 해역(정점 E0, E1, E3)은 천수만 하구둑 부근과 사료투입에 의한 유기물 부하가 극심한 양식장과 유사한 수준의 수층 일차생산력 대비 저층 용출률을 보이고 있었으며, 이와 같이 지속적인 영양염의 용출은 수층의 부영양화를 야기하여 식물플랑크톤 및 유해 조류 대증식을 일으킬 수 있는 잠재적인 오염원으로 작용할 수 있다.
Table 5.
Nutrient demand for primary production (PP) and benthic nutrient flux (BNF) and its contribution to PP in the Lake Shihwa neighboring coastal waters
| Site | PP (mmol m-2d-1) | aDemand for PP (mmol m-2 d-1) | BNF (mmol m-2 d-1) | Contribution of BNF to PP (%) | |||
| DINb | DIPc | DIN | DIP | DIN | DIP | ||
| E0 | 62 | 9.4 | 0.58 | 29.6 | 1.03 | 315 | 178 |
| E1 | 77 | 11.6 | 0.73 | 59.2 | 0.29 | 510 | 40 |
| E3 | 107 | 16.2 | 1.01 | 19.5 | 0.26 | 120 | 26 |
| E5 | 167 | 25.2 | 1.58 | 0.3 | 0.05 | 1 | 3 |
4.4 시화호 방조제 건설과 조력발전에 의한 환경영향
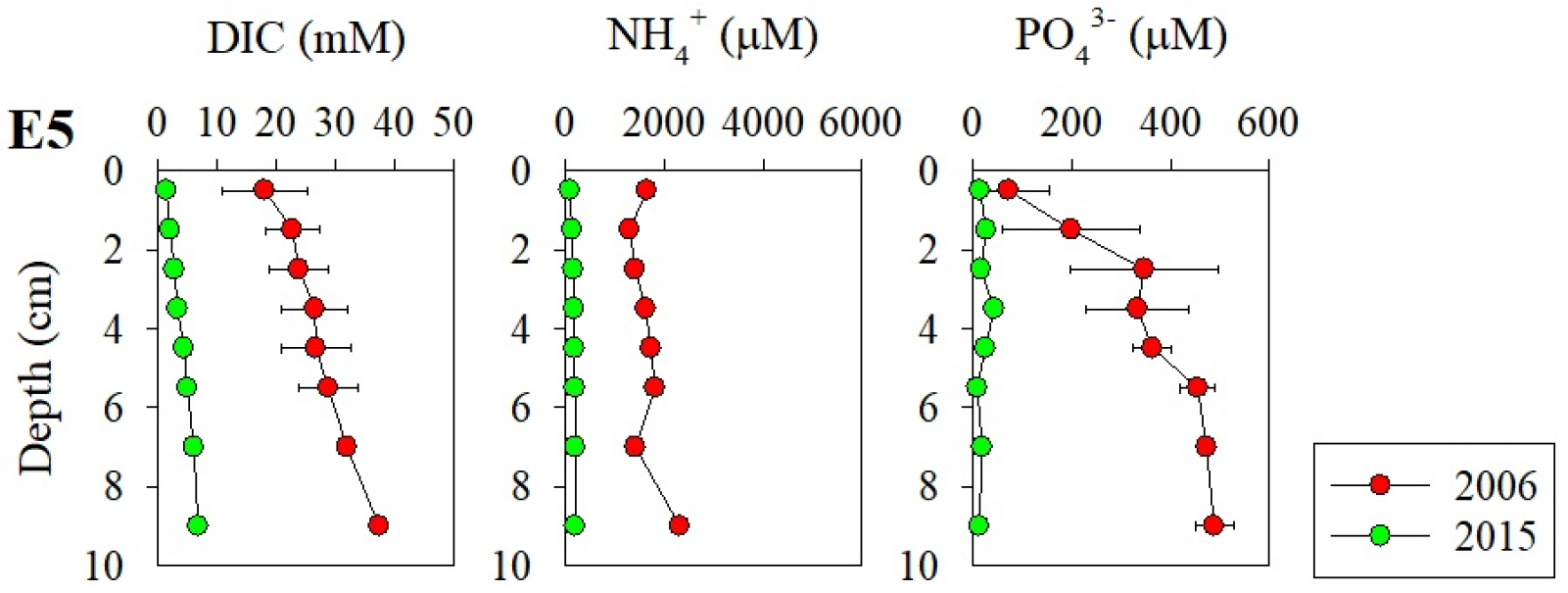
시화호는 담수공급을 목적으로 만들어진 인공 호수이다. 그러나 방조제 건설 이후 내·외측의 해수교환이 제한되어 육상기원의 다양한 오염물질 유입으로 인해 수질 및 저질 환경이 악화되었다. 유사한 사례로 새만금, 영산강, 천수만 등에서 방조제 건설로 인한 해수유통 차단과 방조제 인근 해류 유속 감소로 성층 형성, 유기물 축적에 의한 부영양화 등 많은 환경 변화를 초래한다고 보고하였다(Park et al., 2009; Lee et al., 2012; Kim et al., 2017). 악화된 수질 개선 대책으로 배수갑문을 통한 방류 및 외해수 유입을 실시하였으나 개선효과가 미미하여 해수 유통량의 대폭적인 확대를 통한 수질개선 목적으로 시화조력발전소가 건설되었고, 조력발전소 운영에 따른 시화호 내·외측의 퇴적환경 및 지화학적 특성 변화가 예상된다. 따라서 본 연구에서는 추가적으로 시화호 조력발전 가동에 따른 지화학 특성변화를 알아보기 위해 정점 E5에서 조력발전 건설 이전인 2006년도와 건설 이후인 2015년도의 공극수 내 지화학 성분을 비교하였다. 조력발전 가동 후 퇴적물 공극수 내 용존 무기탄소와 암모니아 및 인산염의 농도는 현저하게 낮아졌다(Fig. 6). 2006년에 조사된 퇴적물 깊이 0–10 cm 까지 누적한 용존 무기탄소(1,543 mmol m-2), 암모니아(117 mmol m-2) 및 인산염(26 mmol m-2) 농도(Hyun, unpublished data)가 2015년에는 각각 277 mmol C m-2, 10.4 mmol N m-2, 1.3 mmol P m-2로 각각 6, 11, 20배 낮게 나타났다. 이는 조력발전 가동 후 방류 시 수문 부근에 발생되는 강한 유속(최대 5.0 m s-1; KWRC, 2015)에 의한 수문 부근에서의 퇴적상 변화(퇴적물 유실과 낮은 퇴적률 등)로 인해 유기물의 축적을 저해시키고, 퇴적물 내 활발한 공극수 교환(tidal flushing)을 일으켜 유기물 분해산물의 재산화 및 수층으로 용출을 야기시킨 것으로 판단된다.