1. 서 론
2. 재료 및 방법
2.1 연구지역 및 시기
2.2 채집 및 분석 방법
2.3 오염도 평가 지수
3. 결 과
3.1 서식환경
3.2 중형저서동물 서식밀도
3.3 우점분류군 서식밀도
3.4 출현 분류군 수
3.5 중형저서동물 크기 분포
3.6 수직분포
3.7 집괴분석
3.8 상관분석
3.9 생물 지수
4. 고 찰
4.1 서식 환경
4.2 중형저서동물 현존량과 군집구조
4.3 중형저서동물 오염도 지수
1. 서 론
황해는 우리나라와 중국에 둘러싸인 반폐쇄형 해역으로, 총 면적 420,000 ㎢, 평균 수심 44 m, 최대 수심 약 100 m의 얕은 대륙붕으로 형성되어 있다. 이러한 지형적 특성으로 인해 많은 양의 지각풍화물질과 오염물질들이 주변 강들로부터 황해로 유입된다(Valencia, 1988). 황해 중앙부의 해저에 축적되는 퇴적물의 양은 연간 약 250 g/㎡으로, 대기를 통한 유입이 약 50 g/㎡, 해류 및 주변 강을 통하여 1년에 약 200 g/㎡이 유입되는 것으로 알려져 있다(Youn and Kim, 2002).
황해는 쿠로시오 해류에서 기원한 고온, 고염분의 황해 난류(Yellow Sea Warm Current, YSWC)와 저온, 저염분의 보하이해에 기원한 중국연안류(Chinese Coastal Current, CCC), 중앙해역의 황해저층냉수괴(Yellow Sea Cold Water Mass, YSCWM)와 한반도 서해안의 서한연안류(West Korea Coastal Current, WKCC), 양쯔강 희석수(Yangtze River or Chiangjiang) Diluted water)등 다양한 해류와 수괴가 존재하고 있어 해수 순환이 상당히 복잡하며, 계절에 따른 해류의 변화가 크다는 특징이 있다(Nitani, 1972; Park et al., 2017). 또한 황해난류를 통해 유입되는 질소, 규소, 인 등의 유기물의 양이 2006년 이후로 증가함에 따라 해역 내 전반적인 영양성분의 농도가 높아졌다(Hyun and Kim, 2003; Xuan et al., 2011; Liu et al., 2015b). 이처럼 황해는 여러 특성을 가진 해류와 수괴가 공존하면서도 퇴적물의 축적으로 인한 퇴적상 변화 및 유기물질의 증가와 같은 환경요인의 변화가 발생하는 해역으로 그 생태학적 변화의 대한 모니터링의 중요성이 점차 증가되고 있다. 또한 황해는 우리나라와 중국 사이에 위치하여 지정학적으로 중요한 위치에 있기에 황해의 대한 지속적인 국내의 연구가 진행되어야 할 가치가 있다. 중국의 경우 황해 중앙역의 대한 연구가 지속되고 있으며, 이 중에서도 저서생태계의 대한 지속적인 생태계 모니터링과 신종 발견의 대한 연구가 진행되고 있다(Cai et al., 2012; Bian et al., 2013; Xu et al., 2016; Liu et al., 2018). 이에 반해 국내의 경우 현재 황해 광역 해역의 저서 생태계 모니터링에 대한 연구 자료들이 해양환경공단의 근해생태계 조사 및 새만금 외해역에서 일부 연구가 진행되었을 뿐, 황해를 전반적으로 아우르는 연구는 소수에 불과하다. 따라서 본 연구에서는 중형저서동물 군집분석을 통해 황해 중앙역의 저서 생태를 확인하고자 한다(Min et al., 2003; Jung et al., 2010).
중형저서동물은 환경변화에 특히 민감하면서(Catalan et al., 2006; Bellard et al., 2012), 해양 생태계 대부분의 장소에 서식하는 생물군이다(Giere, 2008). 다양한 서식처에서 살아가는 중형저서동물은 서식지별 군집 특성 또한 다양하게 나타나며, 그 생태학적 위치도 각각 다르게 나타난다(Coull, 1999; Kang et al., 2014). 일반적으로 중형저서동물은 박테리아, 미세조류 등의 포식자이며 이와 동시에 대형저서동물의 피식자로 저서생태계에서 중요한 위치를 차지하고 있다(Zeppilli et al., 2018).
중형저서동물은 대체로 망목크기 1 ㎜의 체를 통과하여 37 ㎛의 체에 걸러지는 저서생물이다(Shirayama, 1983). 중형저서동물에 속하는 동물군의 주요 종들은 전 생활사를 퇴적물 안에서 보내며 서식을 위해 비교적 안정된 환경을 요구하고, 생활사(Life cycle)가 짧기 때문에, 대형저서동물에 비하여 환경변화에 민감하여 짧은 기간에도 군집의 변화를 보인다고 알려져 있다(Sandulli and Nicola-Giudici, 1990). 또한 중형저서동물의 단위면적당 서식밀도는 퇴적물 1 ㎡당 106~107개체로 다른 생물그룹들에 비해 상대적으로 높아 밀도변화의 감지가 용이하고(Mcintyre, 1969), 조사방법에 있어서도 매우 적은 시료채취만으로도 분석이 가능하기 때문에, 시료채집으로 인한 자연환경의 훼손이 적다는 특징이 있다(Moore and Bett, 1989). 중형저서동물의 이런 특징은 황해의 계절 및 연간 변화를 모니터링하기에 적합한 환경지표 생물이라 할 수 있다(Sandulli and Nicola-Giudici, 1990; Coull and Chandler, 1992).
중형저서동물이 갖고 있는 생태학적 중요도가 높음에도 불구하고, 국내에서는 그동안 많은 연구가 진행되지 않았다. 현재 국내 중형저서동물 연구는 소수의 연구자들에 의해서만 이루어지고 있는데, 서해 장봉도 인근 사질 퇴적물, 독도 주변 해역과 강화도 여차리 갯벌, 가막만 내의 해역, 제주도 연안 지역과 같이 주로 연안에 접한 조간대와 조하대에서 이루어졌다(Kim et al., 2002; Kim et al., 2004; Kang et al., 2011; Kang et al., 2018; Min et al., 2018; Shin et al., 2019; Kang and Kim, 2020). 최근에는 태안 만리포 서식하는 선충류를 대상으로 한 미세플라스틱 섭취에 관한 연구도 이루어져 중형저서동물 군집 및 생태에 대한 연구 뿐 아니라 생리적, 환경적 이슈에 대한 실험적 연구까지 영역이 확대되었다(Kang et al., 2021). 또 다른 연구에서는 중형저서동물을 통한 다양한 환경 지수를 사용하기도 하는 등 국내에 중형저서동물의 대한 연구가 활발하게 진행되고 있다(Lee et al., 2016; Shin et al., 2016; Hong et al., 2020). 이번 연구는 이러한 중형저서동물을 통해 황해 중앙역의 대한 광범위한 생태 모니터링을 진행하고자 하였다.
본 논문에서는 다음과 같은 목적을 가지고 해당 연구를 수행하였다. 첫째, 우리나라 근해 및 한ㆍ중 배타적 경제수역을 포함한 황해는 생태학적, 지정학적 중요성에도 불구하고 중부해역에 대한 중형저서생물의 현존량 및 군집 특성에 대한 국내 자료가 전무한 실정이기 때문에 초기 연구 자료 축적 및 군집 특성 분석을 위해 연구를 수행하였다. 둘째, 황해 대륙붕의 중형저서동물 군집의 현존량에 대한 고찰과 황해의 전반적인 생태학적 가치를 이해하기 위하여 중형저서동물의 공간 및 계절별 군집 변동 양상 및 중형저서동물의 군집구조와 환경요소의 연관성을 찾고, 마지막으로 환경지수를 활용성이 높은 중형저서 오염도 평가지수를 활용하여 건강도에 대한 고찰을 시도하였다.
2. 재료 및 방법
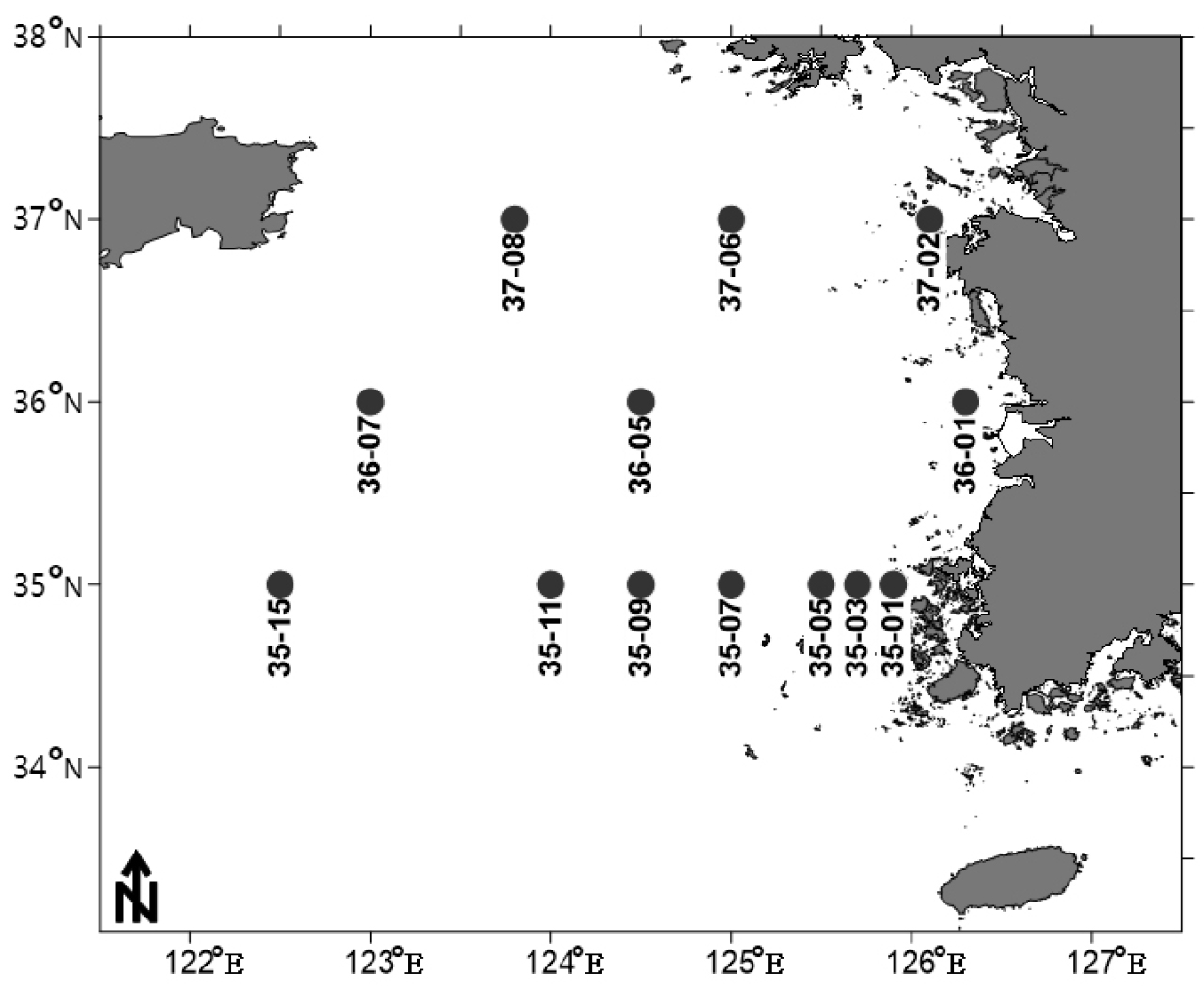
2.1 연구지역 및 시기
중형저서동물 군집 분석을 위한 시료 채집은 황해 중부해역의 정선 북위 35도의 연안에서 외해역에 이르는 수심 18~90 m의 5개 정점(35-03, 35-05, 35-07, 35-09, 35-11)을 선정하여 2018년 10월에 1차 탐사를 진행하였다(Fig. 1). 2019년도 4월에는 보다 광역적인 분포를 확인하고자 35도 정선의 정점 수를 기존의 경우 연안에서 외해역까지 5개에서 연안과 중앙역, 외해역 3개로 줄이고 정선의 수를 35도, 36도, 37도 3개로 늘려 수심 18~85 m의 총 9개의 정점(35-01, 35-11, 35-15, 36-02, 36-05, 36-07, 37-02, 37-06, 37-08)에서 탐사를 진행하였다. 2020년 8월에는 탐사 중 기상악화로 계획했던 37 정선의 대한 조사는 진행하지 못하여, 35, 36 정선에서 정선 당 3개의 정점 씩 총 6개 정점(35-01, 35-11, 35-15, 36-02, 36-05, 36-07)에서 조사를 실시하였다.
2.2 채집 및 분석 방법
시료 채집은 Smith-McIntyre Grab을 이용하여 각 정점에서 퇴적물 시료를 채집하였다. 중형저서동물 군집 분석을 위한 정량 시료 채집은 직경 3.6 ㎝ 크기의 아크릴 코어러를 이용하여 각 정점에서 3개의 퇴적물 코어 시료를 채집하였다. 채집된 퇴적물 시료는 표층으로부터 깊이 5 ㎝까지 각각 1 ㎝ 씩 자른 다음 로즈 벵갈(rose bengal)을 혼합한 5% 중성 포르말린으로 고정하여 연구실로 운반하였다. 운반되어진 시료는 실험실에서 체질을 통하여 1 ㎜ 체를 통과하고 37 ㎛ 체에 남겨진 시료를 분리하였다. 남겨진 시료 퇴적물은 Silica-gel Ludox HS-40을 넣고 원심분리기를 사용하여 밀도차이에 의한 생물 분리 방법으로 중형저서동물을 퇴적물로부터 분리하였다(Burgess, 2001). 퇴적물과 분리된 중형저서동물은 크기별 체(500, 250, 125, 63, 37 ㎛)를 사용하여 각각 크기별로 구분하여 광학현미경 하에서 계수 후 분석하였다.
중형저서동물의 분포는 일반적으로 퇴적물 상층 3 ㎝안에 90% 이상을 차지하고 있어, 퇴적물 상층 3 ㎝까지의 시료를 분석하여 나타내었다. 중형저서동물의 생체량은 Shirayama(1983)의 주요 분류군별 개체당의 Ash free dry weight (㎍) 환산 값을 이용하여 나타내었다. 수층 환경요인인 염분은 CTD를 이용하여 측정하였고 퇴적환경요인 분석을 위해 퇴적물의 온도를 현장에서 측정하였다. 퇴적물의 입도 및 TOC 분석을 위해 각 조사 시에 퇴적물을 냉동 보관하여 실험실로 운반하여 분석하였다(Folk and Ward, 1957; Schumacher, 2002). 채집 시기별 군집구조와 유사도 등을 파악하기 위하여 Bray-Curtis의 유사도지수를 기초로 집괴분석 및 SIMPROF 분석을 실시하여 군집 특성을 확인하였다(Primer v.6). 이중 집괴분석과 입도와 TOC의 데이터를 bubble로 나타내어 일부 환경요소와 군집 특성을 확인하였다(Primer v.6). 환경요소와 군집구조와의 상관관계를 확인하기 위해 PEARSON 상관분석을 진행하였다(Minitab).
2.3 오염도 평가 지수
연구지역 내 각 정점별ㆍ계절별 저서생태계의 오염도 및 건강도를 평가하고자 N/C 값(Nematoda/Copepoda ratio), MPI (Meiobenthic Pollution Index), ITD (Index of Trophic Diversity)를 분석하였다.
N/C ratio (Nematoda/Copepoda ratio)는 환경오염이 진행된 환경에서도 높은 생존률을 보이며, 특히 빈산소환경에 대한 내성이 강한 선충류와 오염에 민감한 저서성 요각류의 생태적 특징을 이용한 평가방법이다. 값이 낮을수록 오염도가 감소하고, 값이 높을수록 오염도의 증가를 지시한다(Raffaelli and Mason, 1981).
MPI (Meiobenthic Pollution Index) 값은 중형저서동물 그룹 중 우점 분류군인 선충류, 저서성 요각류, 다모류의 서식밀도 비를 이용한 지수이다. 값이 낮을수록 오염도가 증가하고, 값이 높을수록 오염도의 감소를 지시한다(Losovskaya, 1983).
ITD (Index of Trophic Diversity) 값은 중형저서동물 그룹 중 가장 우점하는 선충류의 섭식유형을 이용한 지수이다(Heip et al., 1985). 선충류를 4가지 식성으로 구분하고, 값은 0.25 ∼ 1.0의 범위를 갖는다. ITD 지수는 값이 높으면 오염도가 증가하고, 값이 낮으면 오염도의 감소를 지시한다(Jensen, 1987).
3. 결 과
3.1 서식환경
13개 정점의 대한 수심은 Table 1에 나타내었고 각 정점에서의 퇴적물 입자의 구성 비율(Composition), 평균입도(Mean Size), 총 유기물 함량(TOC)은 Table 2에 나타내었다.
Table 1.
Position and water depth of sampling stations in study area
Table 2.
Sediment characteristics at each station in the study area
수심은 연안에서 중앙역으로 갈수록 깊어지다 일정 수심이 유지되는 형태를 가지고 있었다(Table 1). 연구 정점 내 최대 수심과 최소 수심은 정점 35-07에서 90 m로 가장 깊었으며 최소 수심은 정점 35-01에서 18 m로 가장 얕았다.
퇴적물 온도는 8.8~20.7℃로 2020년 8월 정점 35-01, 36-01에서 20.7℃로 가장 높게 나타났다(Table 2). 두 번째로 높게 나타난 정점은 13.1℃를 보인 2018년 10월 정점 35-03이었다. 반면 온도가 가장 낮은 정점은 2019년 4월 35-11로 8.8℃의 온도를 보였다. 다음으로 온도가 낮은 정점은 2019년 4월 36-05, 37-02, 37-06, 37-08로 9.0℃의 퇴적물 온도를 나타냈다.
퇴적물 온도는 수심이 증가하면서 점차 감소하는 경향을 보였다(Table 2). 2019년 4월 채집지역 중심에 위치한 정점 35-11에는 저층냉수대가 있었고, 해당 정점의 퇴적물 온도는 8.8℃로 낮게 나타났다. 서한연안류가 흐르는 정점 35-01, 36-01의 경우 퇴적물 온도가 2019년 4월 11.7℃, 10.7℃이었으며, 2020년 8월에는 정점 35-01, 36-01의 퇴적물 온도가 20.7℃이었다. 2020년 8월 중앙역에 위치한 정점 36-05의 퇴적물 온도는 9.8℃로, 연안에 위치한 정점 35-01, 36-01 보다 10.9℃ 더 낮았다.
모든 정점의 염분도는 31.6~33.0 psu로 평균 32.5 psu의 염분도를 보였다. 계절에 따른 염분도는 2018년 10월에 32.6, 2019년 4월 32.5 psu, 2020년 8월에 32.3 psu로 추계에 가장 높고, 하계에 가장 낮았다. 가장 높은 염분도를 나타낸 정점은 33.3 psu를 보인 2019년 4월 정점 35-15이었고, 다음으로 염분도가 높은 정점 또한 같은 계절인 2019년 4월로 정점 36-7이 33.00 psu를 나타내었다. 반면 가장 낮은 염분도를 보인 정점은 2020년 8월 정점 36-1로 31.6 psu를 나타내었다. 다음으로 염분도가 낮은 정점은 2019년 4월 31.7 psu를 나타낸 정점 37-2로 2019년 4월에 가장 넓은 염분도를 보였고, 염분도는 모든 정선에서 외해역에서 연안으로 올수록 감소하였다.
퇴적물의 구성 중 사질(sand) 비율이 가장 높은 정점은 2019년 36-01로 사질의 비율이 95%를 차지했다(Table 2). 다음으로 사질 비율이 높은 정점은 2019년 4월 94.9%가 나타난 정점 37-06이었다. 이 외 2018년 정점 35-03, 2020년 정점 36-01에서 각각 사질이 79.4%, 76.0% 순으로 높게 나타났다. 실트(silt) 비율이 가장 높게 나타난 정점은 88.6%의 사질로 구성된 2020년 정점 36-07이었다. 다음으로 실트 비율이 높았던 정점은 2020년 정점 35-15로 85.4%의 실트 비율을 보였다. 점토(clay) 비율은 2019년 정점 36-07에서 59.1%로 가장 높게 나타났다. 다음으로 점토 비율이 높은 정점은 2018년 정점 35-11이었으며 57.5%의 점토로 구성되어 있었다. 대부분 정점에서 자갈(gravel)은 0%로 나왔지만 2019년 정점 37-02는 퇴적물 입자 구성비율의 25.2%가 자갈로 구성되어 있었으며, 정점 37-08에는 0.2%의 자갈이 퇴적물에 있었다. 이를 토대로 전반적인 황해의 퇴적물 구성을 보면, 연안에서 중앙역으로 갈수록 사질(sand)의 비율이 감소하고, 점토(clay)와 실트(silt)의 비중이 늘어났다. 특히 정점 35-03, 35-05, 36-01, 37-02와 같이 연안에 가까운 정점은 사질(sand)의 비율이 71~95%로 높게 나타났으며, 중앙역, 외해역에 위치한 정점 35-11, 35-15, 36-07의 경우 사질(sand)의 비율이 0.6~3.0%로 낮게 나타나 연안과 중앙역 및 외해역 간 퇴적물 구성 비율이 다른 것으로 확인되었다.
각 정점에 대한 입도 분석 결과 연안에서 멀어질수록 입도가 증가하는 양상을 보였다. 외해역에 위치한 정점 35-15, 36-07 경우 8.0, 8.8ø의 니질(clay) 의 퇴적물이 나타났다. 반면 중앙역의 정점은 실트(silt)한 퇴적물의 비율이 높았다. 연안 정점의 경우 세립(fine)한 정점이 대부분이었으나, 이중 정점 37-02의 경우 –0.3ø로 극조립(very Coarse)한 퇴적물도 나타났다. 외해역에서 연안으로 올수록 입도는 작아지고, 퇴적물 구성에 사질(sand)의 비중이 늘며 실트(silt), 점토(clay)의 비율이 감소하는 것으로 나타났다.
퇴적물의 총 유기물 함량(TOC)은 0.06~1.46으로 나타났으며 TOC의 평균은 0.62로 나타났다(Table 2). 가장 유기물의 함량이 높은 정점은 36-05로 2019년에 1.46의 TOC값을 보였다. 다음으로 유기물 함량이 높게 나타난 정점은 1.25를 보인 2019년 정점 36-07이었다. 반면 가장 유기물 함량이 낮았던 정점은 0.06인 2019년 정점 37-02이였고 두 번째로 유기물 함량이 낮은 정점은 0.17로 나타난 2020년 정점 36-01이었다. 중앙역에서 연안으로 올수록 퇴적물 유기물 함량이 감소하는 경향은 모든 정선에서 동일하게 나타났으며, 그중 37번 정선에서 감소량이 가장 크게 나타났다.
3.2 중형저서동물 서식밀도
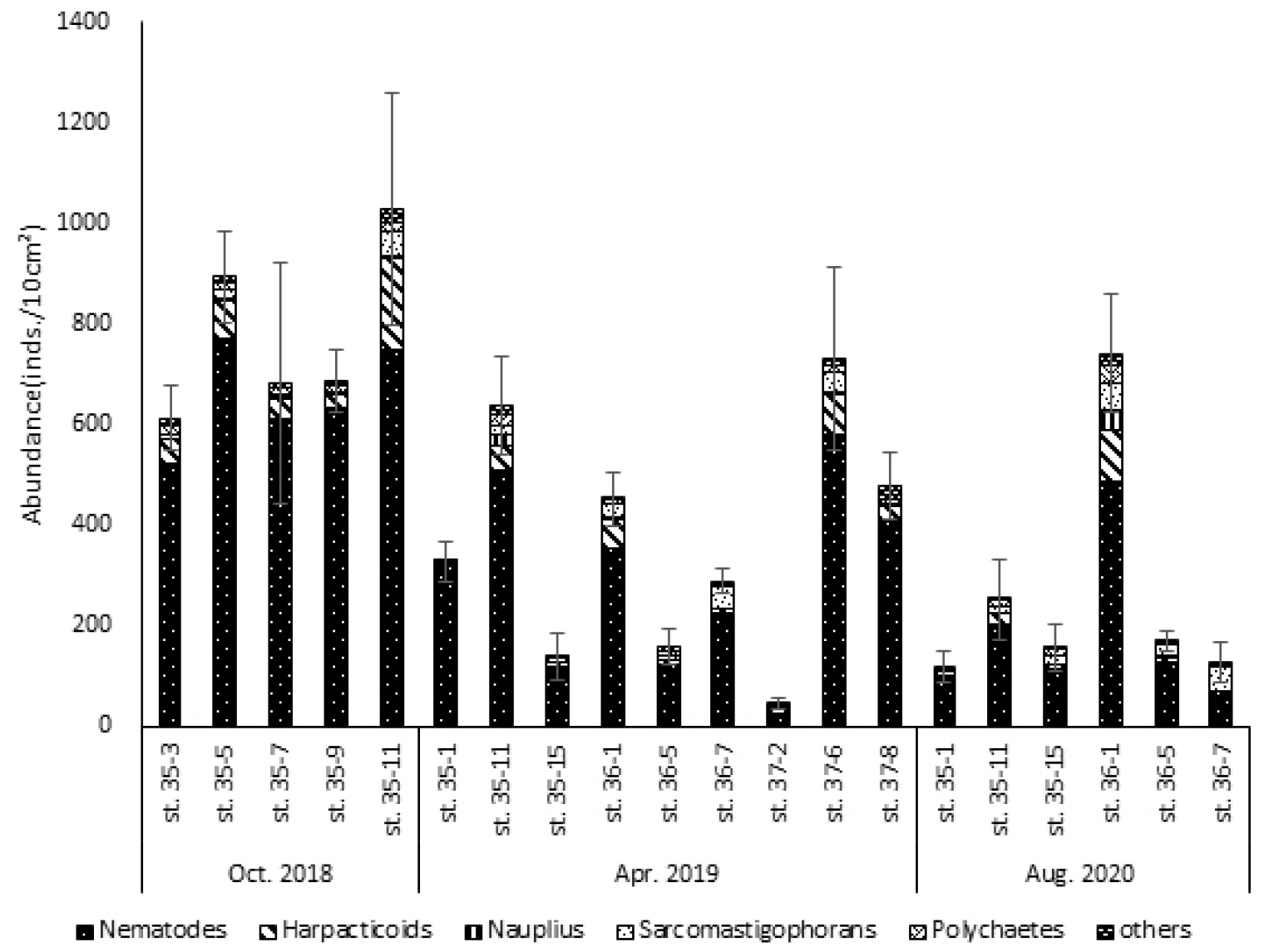
본 연구 조사 시기의 각 정점에서 중형저서동물의 서식밀도를 살펴보면, 가장 높은 값은 2018년 10월 정점 35-11에서 1029±211 inds./10 ㎠값을 보였다. 반대로 가장 낮은 값은 2019년 4월 정점 37-2에서 45±6 inds./10 ㎠값을 나타냈다(Fig. 2, Table 3).
Table 3.
Density of meiofauna (±SD) at each station ±SD during study period
| 2018 | Oct. | ||||||||||||||||||||||||||||||||||||||||||||||
| st. 35-03 | st. 35-05 | st. 35-07 | st. 35-09 | st. 35-11 | |||||||||||||||||||||||||||||||||||||||||||
| Nematodes | 523 | ± 41 | 772 | ± 61 | 612 | ± 203 | 634 | ± 53 | 748 | ± 161 | |||||||||||||||||||||||||||||||||||||
| Harpacticoids | 48 | ± 12 | 75 | ± 15 | 41 | ± 25 | 27 | ± 3 | 181 | ± 39 | |||||||||||||||||||||||||||||||||||||
| Sarcomastigophorans | 9 | ± 3 | 19 | ± 3 | 5 | ± 2 | 5 | ± 1 | 52 | ± 19 | |||||||||||||||||||||||||||||||||||||
| Polychaetes | 19 | ± 1 | 12 | ± 3 | 10 | ± 3 | 10 | ± 2 | 16 | ± 2 | |||||||||||||||||||||||||||||||||||||
| Kinorhynchs | 5 | ± 2 | 9 | ± 4 | 6 | ± 3 | 5 | ± 1 | 19 | ± 3 | |||||||||||||||||||||||||||||||||||||
| Nauplius | 1 | ± 1 | 4 | ± 3 | 3 | ± 2 | 4 | ± 2 | |||||||||||||||||||||||||||||||||||||||
| Tanaidaceans | 4 | ± 0 | 1 | ± 1 | 1 | ± 1 | 1 | ± 1 | 3 | ± 2 | |||||||||||||||||||||||||||||||||||||
| Ostracods | 2 | ± 1 | 1 | ± 1 | 1 | ± 0 | 1 | ± 1 | 2 | ± 1 | |||||||||||||||||||||||||||||||||||||
| Ciliophorans | * | 2 | ± 2 | ||||||||||||||||||||||||||||||||||||||||||||
| Amphipods | 2 | ± 1 | * | * | |||||||||||||||||||||||||||||||||||||||||||
| Turbellarians | 1 | ± 1 | |||||||||||||||||||||||||||||||||||||||||||||
| Priapulids | * | * | |||||||||||||||||||||||||||||||||||||||||||||
| Isopods | * | * | |||||||||||||||||||||||||||||||||||||||||||||
| Cumaceans | * | * | |||||||||||||||||||||||||||||||||||||||||||||
| Tardigrades | * | ||||||||||||||||||||||||||||||||||||||||||||||
| Cnidarians | 1 | ± 1 | |||||||||||||||||||||||||||||||||||||||||||||
| Total | 613 | ± 55 | 893 | ± 73 | 681 | ± 234 | 684 | ± 56 | 1029 | ± 211 | |||||||||||||||||||||||||||||||||||||
| 2019 | Apr. | ||||||||||||||||||||||||||||||||||||||||||||||
| st. 35-01 | st. 35-11 | st. 35-15 | st. 36-01 | st. 36-05 | |||||||||||||||||||||||||||||||||||||||||||
| Nematodes | 321 | ± 38 | 509 | ± 65 | 115 | ± 39 | 352 | ± 16 | 121 | ± 22 | |||||||||||||||||||||||||||||||||||||
| Harpacticoids | 3 | ± 2 | 49 | ± 11 | 4 | ± 1 | 61 | ± 32 | 10 | ± 3 | |||||||||||||||||||||||||||||||||||||
| Sarcomastigophorans | 2 | ± 1 | 16 | ± 5 | 9 | ± 3 | 27 | ± 4 | 9 | ± 3 | |||||||||||||||||||||||||||||||||||||
| Polychaetes | * | 21 | ± 2 | 5 | ± 2 | 7 | ± 1 | 8 | ± 3 | ||||||||||||||||||||||||||||||||||||||
| Nauplius | 24 | ± 7 | * | 2 | ± 1 | * | |||||||||||||||||||||||||||||||||||||||||
| Kinorhynchs | 12 | ± 3 | 3 | ± 0 | * | 3 | ± 2 | ||||||||||||||||||||||||||||||||||||||||
| Ostracods | 4 | ± 2 | * | * | * | ||||||||||||||||||||||||||||||||||||||||||
| Tanaidaceans | 2 | ± 1 | 4 | ± 2 | |||||||||||||||||||||||||||||||||||||||||||
| Bivalves | * | 1 | ± 1 | ||||||||||||||||||||||||||||||||||||||||||||
| Ciliophorans | 1 | ± 1 | * | * | * | ||||||||||||||||||||||||||||||||||||||||||
| Gastropods | * | ||||||||||||||||||||||||||||||||||||||||||||||
| Amphipods | * | ||||||||||||||||||||||||||||||||||||||||||||||
| Total | 327 | ± 39 | 637 | ± 83 | 138 | ± 44 | 451 | ± 17 | 157 | ± 33 | |||||||||||||||||||||||||||||||||||||
| 2019 | Apr. | ||||||||||||||||||||||||||||||||||||||||||||||
| st. 36-07 | st. 37-02 | st. 37-06 | st. 37-08 | ||||||||||||||||||||||||||||||||||||||||||||
| Nematodes | 227 | ± 13 | 23 | ± 4 | 580 | ± 128 | 409 | ± 42 | |||||||||||||||||||||||||||||||||||||||
| Harpacticoids | 7 | ± 2 | 11 | ± 4 | 78 | ± 32 | 27 | ± 5 | |||||||||||||||||||||||||||||||||||||||
| Sarcomastigophorans | 43 | ± 6 | 4 | ± 1 | 36 | ± 10 | 5 | ± 2 | |||||||||||||||||||||||||||||||||||||||
| Polychaetes | 7 | ± 1 | 4 | ± 1 | 17 | ± 2 | 7 | ± 2 | |||||||||||||||||||||||||||||||||||||||
| Nauplius | * | * | 8 | ± 4 | 3 | ± 3 | |||||||||||||||||||||||||||||||||||||||||
| Kinorhynchs | 4 | ± 2 | 7 | ± 3 | |||||||||||||||||||||||||||||||||||||||||||
| Ostracods | * | 2 | ± 1 | 3 | ± 2 | 13 | ± 7 | ||||||||||||||||||||||||||||||||||||||||
| Tanaidaceans | 2 | ± 2 | * | 3 | ± 1 | ||||||||||||||||||||||||||||||||||||||||||
| Bivalves | 3 | ± 1 | 3 | ± 1 | |||||||||||||||||||||||||||||||||||||||||||
| Ciliophorans | * | * | |||||||||||||||||||||||||||||||||||||||||||||
| Gastropods | 1 | ± 1 | * | ||||||||||||||||||||||||||||||||||||||||||||
| Amphipods | 1 | ± 1 | |||||||||||||||||||||||||||||||||||||||||||||
| Insects | * | ||||||||||||||||||||||||||||||||||||||||||||||
| Total | 289 | ± 17 | 45 | ± 6 | 732 | ± 168 | 478 | ± 54 | |||||||||||||||||||||||||||||||||||||||
| 2020 | Aug. | ||||||||||||||||||||||||||||||||||||||||||||||
| st. 35-01 | st. 35-11 | st. 35-15 | st. 36-01 | st. 36-05 | st. 36-07 | ||||||||||||||||||||||||||||||||||||||||||
| Nematodes | 94 | ± 21 | 203 | ± 63 | 114 | ± 31 | 489 | ± 76 | 128 | ± 13 | 68 | ± 15 | |||||||||||||||||||||||||||||||||||
| Sarcomastigophorans | 8 | ± 2 | 14 | ± 7 | 16 | ± 7 | 56 | ± 6 | 21 | ± 6 | 49 | ± 22 | |||||||||||||||||||||||||||||||||||
| Harpacticoids | 6 | ± 2 | 20 | ± 4 | 9 | ± 2 | 102 | ± 17 | 10 | ± 1 | 2 | ± 1 | |||||||||||||||||||||||||||||||||||
| Polychaetes | 1 | ± 1 | 9 | ± 4 | 11 | ± 5 | 34 | ± 6 | 8 | ± 1 | 5 | ± 1 | |||||||||||||||||||||||||||||||||||
| Nauplius | 2 | ± 1 | 4 | ± 1 | 1 | ± 0 | 38 | ± 3 | 2 | ± 1 | |||||||||||||||||||||||||||||||||||||
| Ostracods | 1 | ± 1 | * | 10 | ± 4 | * | * | ||||||||||||||||||||||||||||||||||||||||
| Ciliophorans | 8 | ± 4 | |||||||||||||||||||||||||||||||||||||||||||||
| Turbellarians | 2 | ± 1 | * | 2 | ± 2 | 0 | ± 0 | ||||||||||||||||||||||||||||||||||||||||
| Amphipods | * | 2 | ± 1 | * | 1 | ± 1 | |||||||||||||||||||||||||||||||||||||||||
| Others | 1 | ± 1 | 3 | ± 2 | 1 | ± 1 | |||||||||||||||||||||||||||||||||||||||||
| Kinorhynchs | * | ||||||||||||||||||||||||||||||||||||||||||||||
| Gastrotrichs | * | ||||||||||||||||||||||||||||||||||||||||||||||
| Priapulids | 1 | ± 1 | |||||||||||||||||||||||||||||||||||||||||||||
| Bivalves | * | ||||||||||||||||||||||||||||||||||||||||||||||
| Insects | * | ||||||||||||||||||||||||||||||||||||||||||||||
| Total | 117 | ± 18 | 251 | ± 77 | 155 | ± 43 | 741 | ± 96 | 170 | ± 19 | 126 | ± 34 | |||||||||||||||||||||||||||||||||||
2018년 10월 가을에 조사한 35번 정선의 5개 정점의 평균 서식밀도는 800±69 inds./10 ㎠로 나타났다. 2018년 10월 가을 조사에서 가장 서식밀도가 높은 정점은 1029±211 inds./10 ㎠를 보인 정점 35-11이었다. 반면 2018년 10월 가을 조사에서 가장 서식밀도가 낮은 정점은 613±55 inds./10 ㎠를 나타낸 정점 35-03이었다.
2019년 4월 봄에 조사한 9개 정점의 평균 서식밀도는 404±51 inds./10 ㎠로 나타났다. 2019년 4월 봄 조사에서 가장 높은 서식밀도를 보인 정점은 37-06으로 732±168 inds./10 ㎠의 서식밀도를 보였다. 다음으로 서식밀도가 높은 정점은 637±82 inds./10 ㎠을 보인 정점 35-11이었다. 2019년 4월에 가장 낮은 서식밀도를 보인 정점은 45±6 inds./10 ㎠를 보인 정점 37-02이었다. 2019년 4월에 다음으로 낮은 서식밀도를 보인 정점은 138±43 inds./10 ㎠의 서식밀도를 나타낸 정점 35-15이었다.
2020년 8월 여름에 조사한 6개 정점의 평균 서식밀도는 260±48 inds./10 ㎠로 나타났다. 2020년 8월 여름 조사에서 정점 36-01이 741±96 inds./10 ㎠로 가장 높은 서식밀도를 나타냈다. 다음으로 높은 서식밀도를 보인 정점은 정점 35-11로 251±77 inds./10 ㎠의 서식밀도를 보였다. 반면 2020년 8월 여름 정정 중 정점 35-01이 117±18 inds./10 ㎠로 가장 낮은 서식밀도를 보였다.
중형저서동물 서식밀도의 계절적 변동은 다음과 같다. 추계인 2018년 10월에 평균 서식밀도는 800±69 inds./10 ㎠로 가장 높았다. 서식밀도가 다음으로 높았던 계절은 춘계로 404±51 inds./10 ㎠의 서식밀도를 보였다. 2020년 8월 하계의 중형저서동물 서식밀도는 260±48 inds./10 ㎠로 가장 낮았다. 2019년 4월에는 2018년 8월의 중형저서동물 서식밀도에 비하여 52.3% 적게 나타났고, 2020년 8월에는 2018년, 2019년에 비하여 67.4%, 36.1%만큼 적게 출현하였다.
35, 36, 37 정선이 모두 조사된 2019년 4월의 각 정선별 서식밀도를 확인하였다. 37 정선의 중형저서동물 서식밀도가 평균 418±228 inds./10 ㎠로 가장 높았다. 반면 36 정선의 중형저서동물 서식밀도는 평균 299±36 inds./10 ㎠로 가장 낮았다. 35 정선의 중형저서동물 서식밀도는 368±85 inds./10 ㎠로 36 정선 보다는 높고 37 정선 보다는 낮았다(Fig. 2, Table 3).
3.3 우점분류군 서식밀도
본 연구에서 정점별, 계절별로 출현한 중형저서동물 분류군 중 가장 우점한 분류군은 선충류(Nematodes, 80.8%)로 나타났으며 출현 분류군 중 선충류의 비율은 51.5∼98.1%였다(Fig. 3, Table 3). 선충류 다음으로 우점한 분류군은 정점별로 다르지만 저서성 요각류(Harpacticoids, 8.8%), 저서성 유공충류(Sarcomastigophorans, 4.7%), 갑각류 유생(Nauplius, 2.4%), 다모류(Polychaetes, 1.1%)순으로 나타났다. 위 5개 분류군의 서식밀도 비율은 전체 중형저서동물 서식밀도의 98.8%를 차지하는 것으로 나타났다.
최우점 분류군인 선충류의 평균 서식밀도는 352±55 inds./10 ㎠였다. 선충류의 서식밀도는 2018년 10월 정점 35-05에서 772±61 inds./10 ㎠로 가장 높게 나타났으며, 선충류 서식밀도 비율이 가장 높게 나타난 정점은 2019년 4월 정점 35-01으로, 전체 중형저서동물 중 98.1%를 차지했다. 개체 수가 가장 많게 나타난 정점과 선충류의 서식밀도 비율이 가장 높게 나타난 정점은 일치하지 않는 결과를 보였다. 그러나 가장 낮은 서식밀도를 가진 정점은 선충류의 서식밀도 비율이 가장 낮게 나타난 정점과 동일하였다. 해당 정점은 2019년 4월 정점 37-02로 23±4 inds./10 ㎠의 서식밀도를 보였으며 우점분류군 서식밀도에서 선충류가 차지하는 비율은 51.5%로 나타났다. 이는 모든 계절 및 정점에서 가장 낮은 선충류의 비율로 2020년 8월 정점 37-02이 가장 낮은 선충류 서식밀도를 보인 정점이자 우점분류군 서식밀도에서 가장 낮은 선충류 비율을 보인 정점이었다. 각 시기별 선충류의 평균 서식밀도는 2018년 10월 658±104 inds./10 ㎠가 출현하여 선충류 비율은 약 85.4%의 비율을 나타냈고, 2019년 4월에는 332±41 inds./10 ㎠로 약 79.0%의 선충류 비율을 나타냈다. 2020년 8월에 선충류 서식밀도는 183±37 inds./10 ㎠로 약 71.7%의 비율을 차지했다.
환경에 민감한 것으로 알려진 저서성 요각류는 두 번째 우점분류군으로 나타났다. 저서성 요각류의 평균 서식밀도는 39±11 inds./10 ㎠로 나타났다. 가장 높은 서식밀도를 보인 정점은 2018년 10월 정점 35-11로 181±39 inds./10 ㎠의 저서성 요각류가 출현하였다. 반대로 저서성 요각류의 서식밀도가 가장 낮은 정점은 2020년 8월 정점 36-07로 2±1 inds./10 ㎠가 출현하였다. 계절별 저서성 요각류의 서식밀도는 2018년 10월에 평균 74±19 inds./10 ㎠, 2019년 4월 평균 33±10 inds./10 ㎠, 2020년 8월 25±4 inds./10 ㎠로 나타났다. 가을에 가장 높은 서식밀도를 보이고, 봄, 여름 순 서식밀도가 높았다. 이외 외해역에 위치한 정점 35-15, 36-07, 37-08의 저서성 요각류 서식밀도가 다른 정점들 보다 낮았다(Table 3). 정점 35-15, 36-07, 37-08의 평균 서식밀도는 10±2 inds./10 ㎠로 전체 평균 서식밀도 39±11 inds./10 ㎠에 비하여 매우 낮게 나타났다.
저서성 유공충류(Sarcomastigophorans)의 평균 서식밀도는 20±6 inds./10 ㎠로 나타났다. 저서성 유공충류의 서식밀도는 2020년 8월 정점 36-01에서 56±6 inds./10 ㎠로 가장 높게 나타났다. 그 다음으로 저서성 유공충류의 서식밀도가 높은 정점은 52±19 inds./10 ㎠, 49±22 inds./10 ㎠의 서식밀도를 보인 2018년 10월 정점 35-11, 2020년 8월 정점 36-07이었다. 대부분 정점에서 저서성 요각류가 두 번째 우점분류군으로 나타났으나, 2020년 8월 정점 36-07을 포함한 5개 정점에서는 저서성 유공충류가 두 번째로 우점하는 것으로 나타났다. 이 중 2020년 8월 정점 36-07에서는 전체 서식밀도 중 39.1%의 비율을 나타냈다. 이는 이번 연구에서 저서성 유공충류의 평균 서식밀도비(7.1%)에 비하여, 약 5배의 높은 값이다.
다모류(Polychaetes)의 평균 서식밀도는 11±2 inds./10 ㎠로 나타났다. 계절에 따른 다모류의 평균 서식밀도는 2018년 10월 가을에 13±2 inds./10 ㎠, 2019년 4월 9±2 inds./10 ㎠, 2020년 8월 여름에 12±3 inds./10 ㎠가 출현하였다. 가장 높은 다모류 서식밀도는 2020년 8월 정점 36-01에서 34±6 inds./10 ㎠로 나타났다. 반면에 가장 낮은 다모류 서식밀도는 1±1 inds./10 ㎠로 2020년 8월 35-01 정점에서 나타났다.
갑각류 유생(Nauplius)의 평균 서식밀도는 5±1 inds./10 ㎠로 나타났다. 갑각류 유생은 2020년 8월 정점 36-01에서 38±6 inds./10 ㎠로 가장 높은 서식밀도를 나타냈다. 반면 갑각류 유생은 우점 분류군에 속하지만 미출현한 정점도 있었다. 2018년 10월 정점 35-09, 35-11, 2020년 8월 정점 36-07에서 갑각류 유생이 출현하지 않았다. 각 계절별로 갑각류 유생의 평균 서식밀도는 2018년 10월에 3±2 inds./10 ㎠, 2019년 4월에 5±2 inds./10 ㎠, 2020년 8월에 8±1 inds./10 ㎠를 나타내었다.
3.4 출현 분류군 수
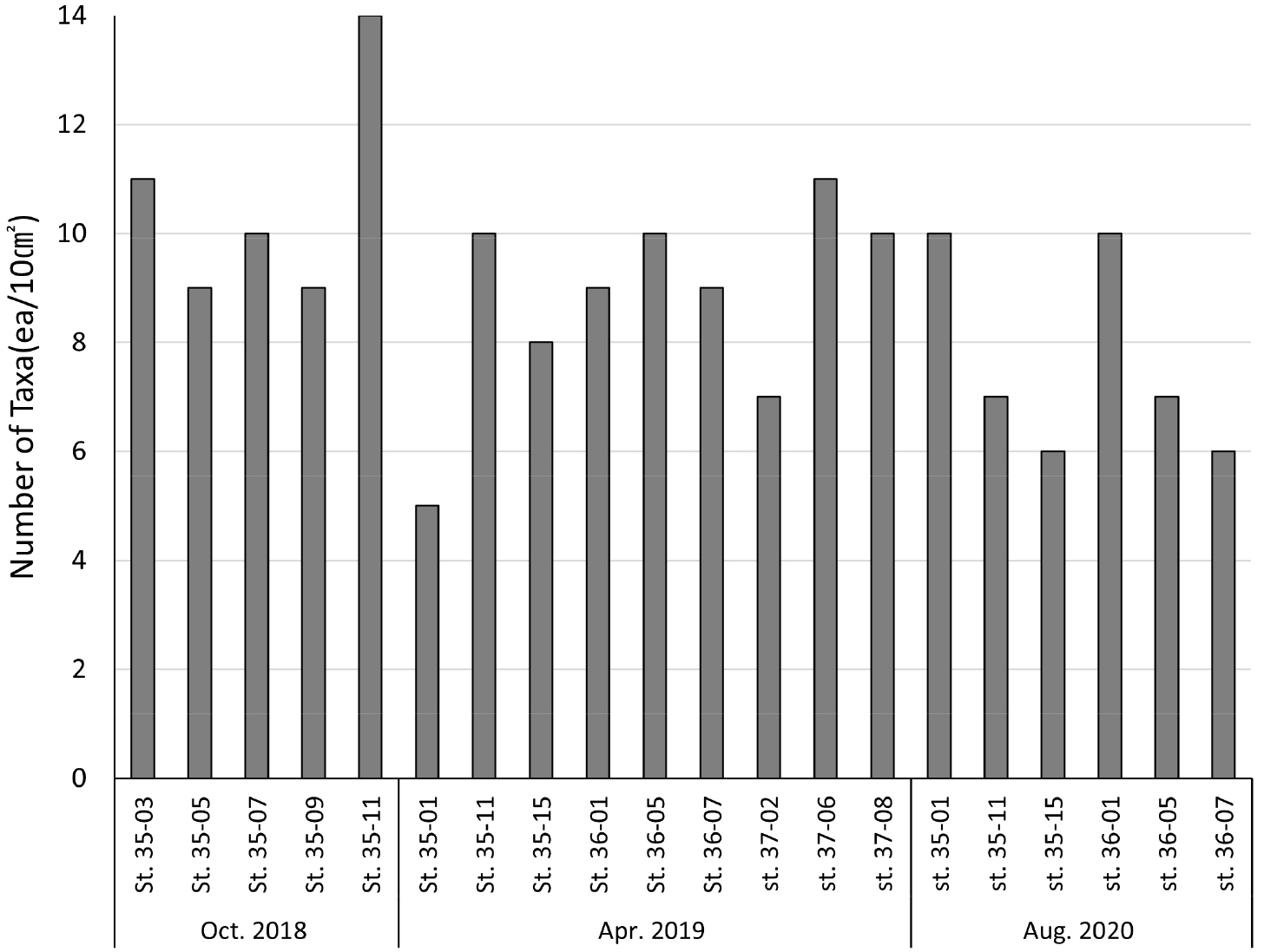
각 정점별, 년도별 중형저서동물 출현 분류군 수는 Table 2에 나타냈다. 중형저서동물 출현 분류군 수는 2018년 10월 정점 35-11에서 14개로 가장 높게 나타났다. 반면 2019년 5월 정점 35-01에서는 5개로 가장 낮게 나타났다. 계절에 따른 분류군 수는 2018년 10월 가을에 14개로 가장 높게 나타났고, 2019년 4월 봄에는 11개로 나타났으며, 2020년 8월 여름의 출현 분류군 수는 10개로 가장 낮게 나타나 가을, 봄, 여름 순으로 높게 나타났다. 2019년 4월 기준 각 정선별 출현 중형저서동물 분류군 수는 35 정선에서 14개로 나타났으며, 36, 37 정선이 각각 10개로 나타났다. 이외에도 동일 정점에서 계절이 변함에 따른 출현 분류군 수가 달랐다. 정점 35-01은 2019년 5개의 출현 분류군 수를 나타냈지만 2020년에는 10개로 많은 분류군이 출현하였다(Fig. 4).
3.5 중형저서동물 크기 분포
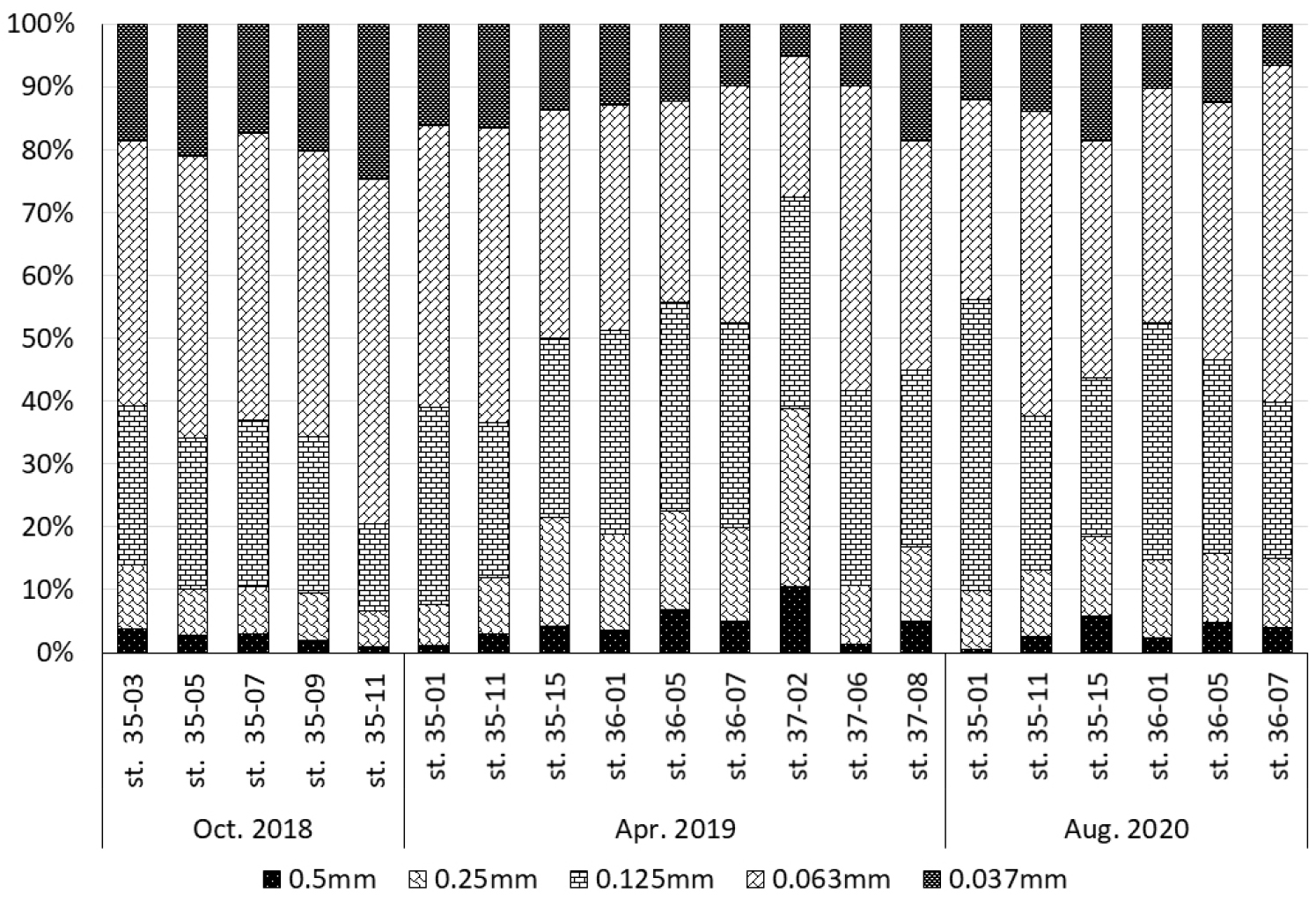
각 정점별, 년도별 중형저서동물 크기 분포는 500, 250, 125, 63, 37 ㎛ 순으로 4%, 12%, 29%, 41%, 15%로 나타났다. 황해 지역에 서식하는 중형저서동물의 크기 분포는 모든 정점에서 63 ㎛의 망목을 통과하고 125 ㎛크기의 체에 걸러지는 개체가 41%로 가장 많이 서식하는 것으로 나타났다(Fig. 5). 다음으로 125 ㎛의 망목을 통과하고 250 ㎛크기의 체에 걸러지는 평균 29%로 대부분의 정점에서 높게 나타났다. 500 ㎛크기의 체에 걸러지는 개체가 차지하는 비율은 4%로 다른 크기에 비하여 상대적으로 낮은 값을 보였다.
각 계절별 중형저서동물의 크기분포는 2018년 10월 가을에 500 ㎛에서 2%, 250 ㎛에서 8%, 125 ㎛에서 23%, 63 ㎛에서 47%, 37 ㎛ 20%로 나타났다. 2019년 4월 봄 중형저서동물 크기분포는 500 ㎛에서 4%, 250 ㎛에서 14%, 125 ㎛에서 31%, 63 ㎛에서 38%, 37 ㎛에서 13%로 나타났다. 2020년 8월 여름의 중형저서동물 크기분포는 500 ㎛에서 3%, 250 ㎛에서 11%, 125 ㎛에서 32%, 63 ㎛에서 42%, 37 ㎛에서 12%로 나타났다. 2018년 10월과 2020년 8월의 경우 37 ㎛의 망목을 통과하고 63 ㎛크기의 체에 걸러지는 중형저서동물이 259 ㎛의 망목을 통과하고 500 ㎛크기의 체에 걸러지는 개체보다 더 많은 비율을 차지했다. 하지만 2019년 4월 봄 중형저서동물 크기분포에서는 37 ㎛의 망목을 통과하고 63 ㎛크기의 체에 걸러지는 중형저서동물이 13%인 반면에 250 ㎛의 망목을 통과하고 500 ㎛크기의 체에 걸러지는 중형저서동물이 14%로 더 많은 비율을 차지하였다. 63 ㎛의 망목을 통과하고 125 ㎛크기의 체에 걸러지는 중형저서동물이 모든 계절에서 가장 많은 크기분포를 차지했다. 하지만63 ㎛의 망목을 통과하고 125 ㎛크기의 체에 걸러지는 개체가 차지하는 비율은 계절별로 2018년 10월에 47%, 2020년 8월에 42%, 2019년 4월에 38%로 계절 간 다르게 나타났다. 37 ㎛의 망목을 통과하고 63 ㎛크기의 체에 걸러지는 크기인 중형저서동물의 경우에도 2018년 10월에 20%로 2019년 4월 13%와 2020년 8월 12%에 비교하면 높은 비율로 나타나 계절 간 중형저서동물의 크기 분포가 다르게 나타났다.
가장 높은 중형저서동물 크기 분포비를 갖는 63 ㎛의 망목을 통과하고 125 ㎛크기의 체에 걸러지는 중형저서동물은 정점별 ‧ 연도별로 살펴보면 다음과 같다. 2020년 8월 정점 36-07에서 54%로 가장 많은 비율로 나타났다. 반면 가장 낮은 비율로 나타난 정점은 2019년 4월 정점 37-02로 22%를 나타났다. 2019년 4월 정점 37-02의 경우 오히려 125 ㎛의 망목을 통과하고 250 ㎛크기의 체에 걸러지는 개체가 차지하는 비율이 34%로 높게 나타났다. 2019년 4월 정점 37-02은 다른 크기에서도 250 ㎛의 망목을 통과하고 500 ㎛크기의 체와 500 ㎛크기의 체에 걸러지는비율이 28%, 10%로 다른 정점에 비하여 높게 나타났는데 해당 정점의 경우 중형저서동물 서식밀도가 45 inds./10 ㎠로 평균보다 매우 낮았다.
3.6 수직분포
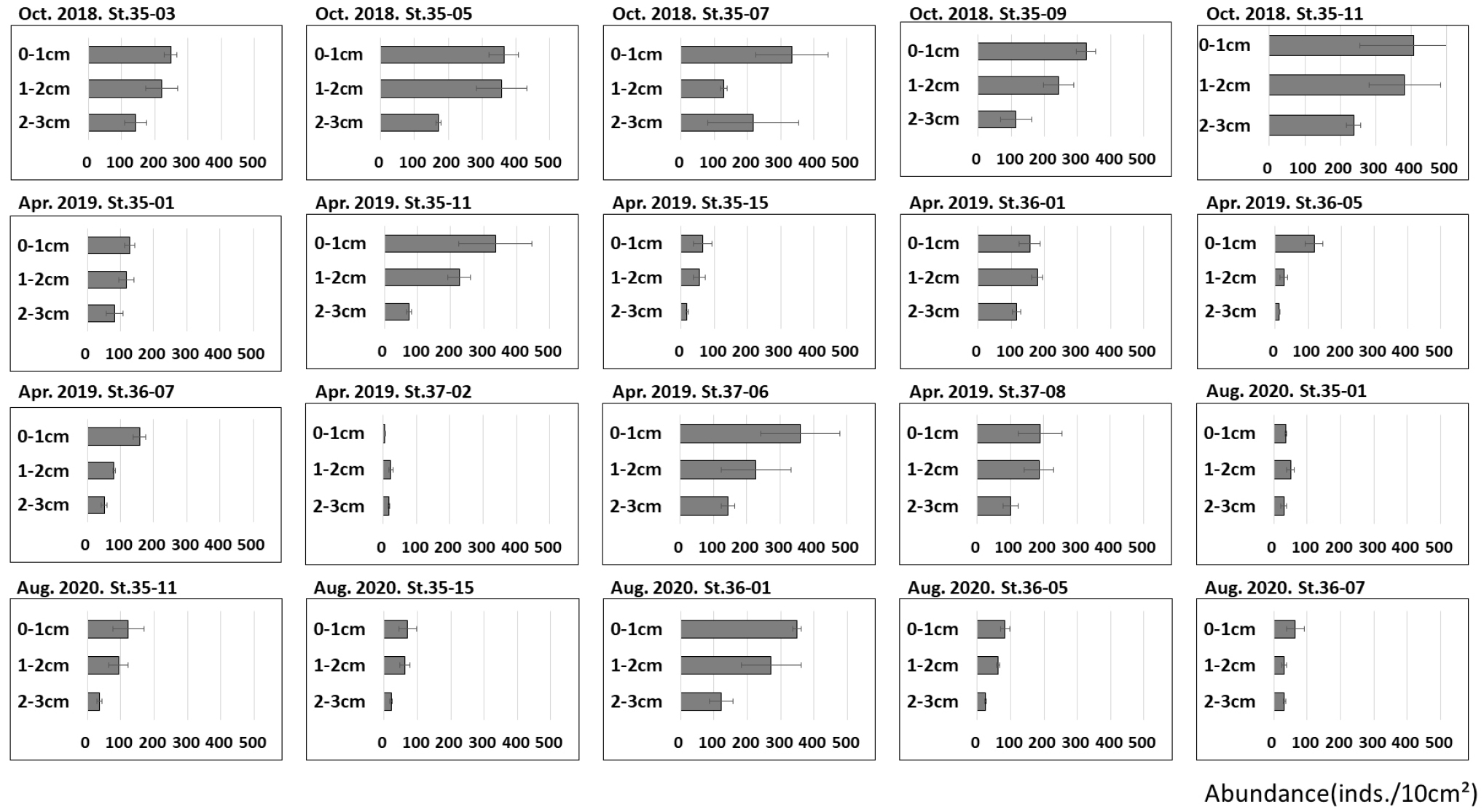
각 정점의 0∼3 ㎝퇴적물 내 중형저서동물 수직분포를 분석한 결과, 대부분 정점에서 퇴적물의 깊이가 증가함에 따라 중형저서동물 서식밀도가 감소하는 것으로 나타났다(Fig. 6). 모든 정점의 평균 수직분포는 0~1 ㎝층에서 191±45 inds./10 ㎠, 1~2 ㎝층에서 151±35 inds./10 ㎠, 2~3 ㎝층에서 88±21 inds./10 ㎠로 퇴적물 표층으로부터 깊이가 깊어짐에 따라 감소하였다.
각 계절별 평균 수직분포를 살펴보면 2018년 10월에는 0~1 ㎝ 336±71 inds./10 ㎠, 1~2 ㎝ 267±56 inds./10 ㎠, 2~3 ㎝층에서 177±49 inds./10 ㎠로 감소하였다. 2019년 4월에는 0~1 ㎝층에서 168±48 inds./10 ㎠, 1~2 ㎝층에서 125±29 inds./10 ㎠, 2~3 ㎝층에서 69±12 inds./10 ㎠로 나타났다. 2020년 8월에 0~1 ㎝층에서 121±21 inds./10 ㎠, 1~2 ㎝층에서 95±27 inds./10 ㎠, 2~3 ㎝층에서 44±10 inds./10 ㎠로 나타났다. 모든 계절에서 동일하게 퇴적물의 깊이가 깊어짐에 따른 중형저서동물의 서식밀도는 감소하였다.
대부분 정점에서 동일하게 퇴적물 깊이가 감소함에 따라 서식밀도가 감소하였다. 하지만 일부 정점에서는 수직분포가 비슷하게 나타나거나, 깊이가 깊어질수록 서식밀도가 증가하는 등 일반적인 수직분포 양상과 다른 정점들도 존재했다. 2018년 정점 35-05, 35-11, 2019년 정점 35-01, 37-08에서는 서식밀도가 깊어짐에 따른 감소가 나타났으나 0~1 ㎝층과 1~2 ㎝층 간의 서식밀도가 비슷하게 나타났다. 4개 정점의 평균 서식밀도를 보면 0~1 ㎝층은 272±69 inds./10 ㎠, 1~2 ㎝층은 261±61 inds./10 ㎠로 나타났다. 2019년 정점 36-01, 35-01에서는 표층인 0~1 ㎝ 보다 1~2 ㎝층이 더 높은 서식밀도를 보였다(Fig. 6). 그러나 이들 정점도 2~3 ㎝층에서 중형저서동물의 서식밀도가 감소하였다. 이외에도 2020년 8월 정점 36-07은 1~2 ㎝층과 2~3 ㎝층 모두 31±6 inds./10 ㎠로 수직분포가 비슷하게 나타났다. 2019년 정점 37-02의 경우 1~2 ㎝층에서 23±7 inds./10 ㎠로 나타났지만 0~1 ㎝층은 5±1 inds./10 ㎠로 표층이 더 적은 정점도 있었다. 일반적인 특징에서는 벗어나지 않지만 2019년 4월 정점 36-05의 경우 0~1 ㎝층은 118±26 inds./10 ㎠였지만, 1~2 ㎝층은 27±11 inds./10 ㎠였고 2~3 ㎝층은 12±1 inds./10 ㎠로 퇴적물의 깊이가 깊어짐에 따른 서식밀도의 감소가 일어났으나 다른 정점 및 시기에 비하여 표층의 서식밀도가 매우 높게 나타났다.
3.7 집괴분석
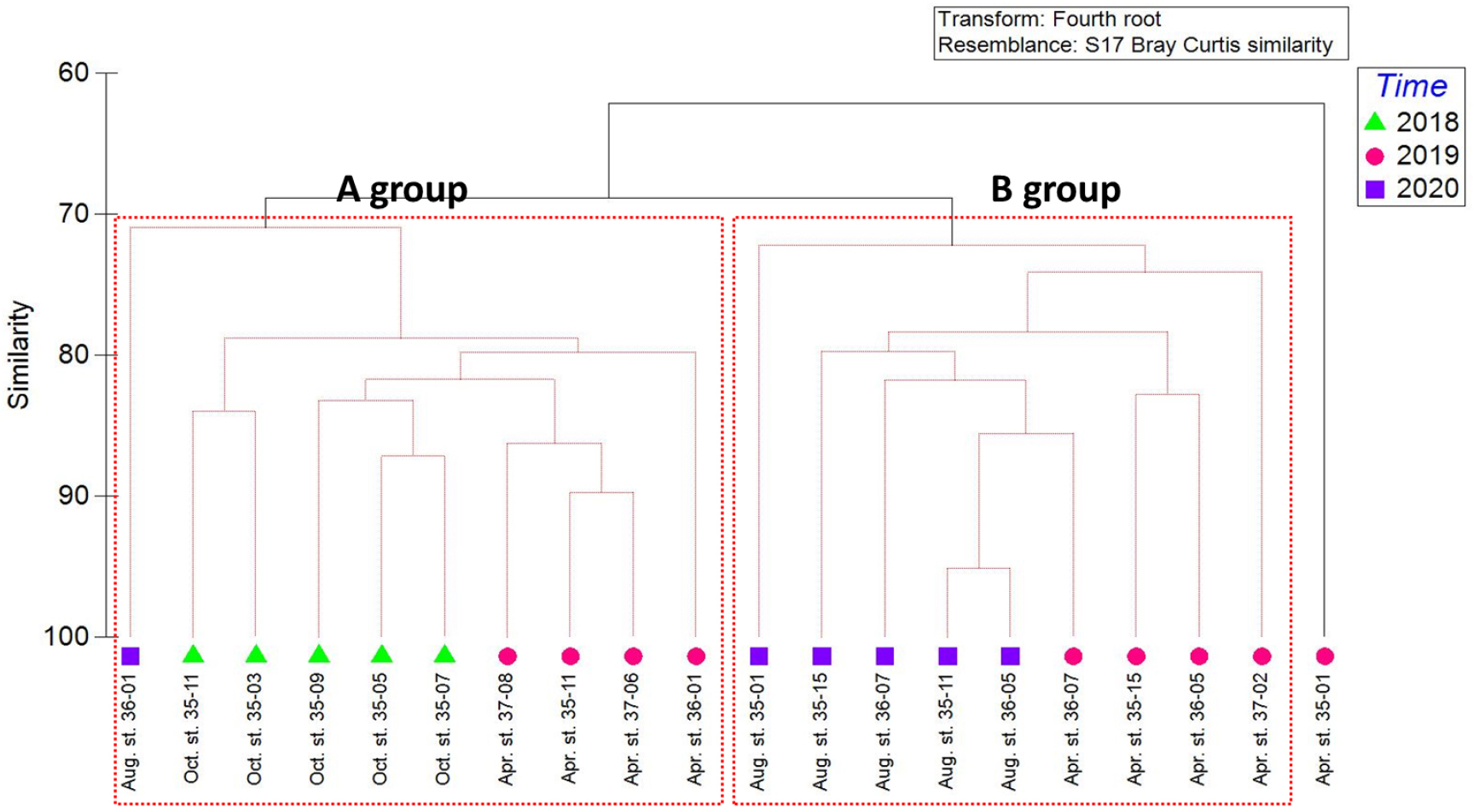
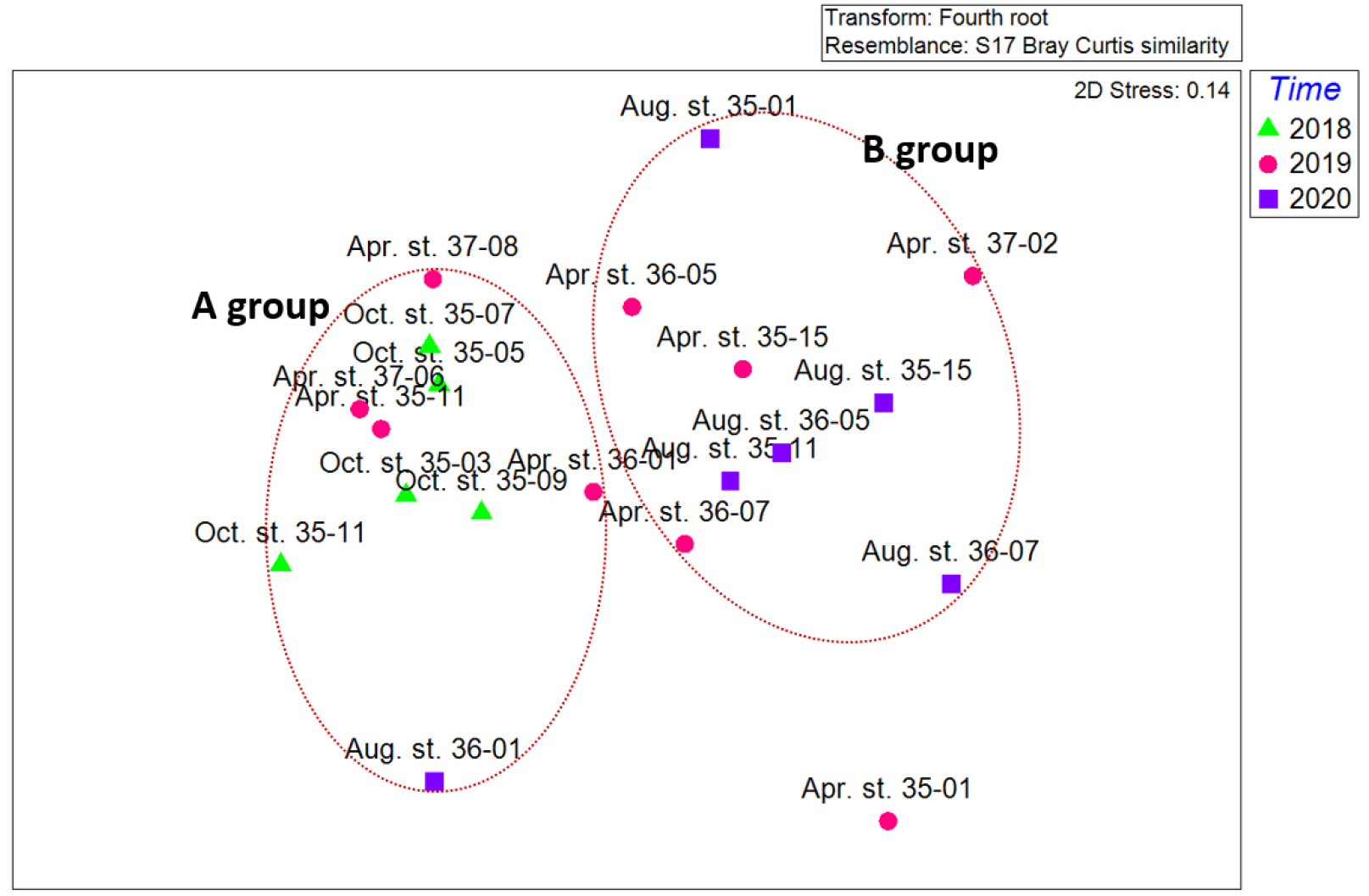
조사기간 동안 출현한 중형저서동물의 각 분류군과 개체수의 자료를 이용하여 MDS와 SIMPROF 분석을 실시하였다(Figs. 7, 8). 집괴분석 결과 2개의 그룹으로 구분되어졌다. A group은 2018년 5개 정점(35-03, 35-05, 35-07, 35-09, 35-11)과 2019년 4월 정점 35-11, 36-11, 37-06, 37-08, 2020년 정점 36-01을 포함하였다. B group은 2020년 8월 5개 정점(35-01, 35-11, 35-15, 36-05, 36-07)과 2019년 4월 4개 정점(35-15, 36-05, 36-07, 37-02)을 포함하였다. 두 그룹에 모두 속하지 않는 것으로 나온 정점은 2019년 4월 정점 35-01이다.
정점 간 유사도를 보면 A group의 경우 유사도가 72%에서 2020년 정점 36-01이 나눠지고 80%에서 네 그룹으로 세분화되었다. 2019년 4월 정점 36-01과 2019년 4월 3개 정점으로 나눠진다. 2018년 정점은 정점 35-03, 35-11 두 정점과 이외 2018년 3개 정점으로 세분화되었다.
B group의 경우 2020년 8월 정점 35-01이 73%, 2019년 4월 정점 37-02가 75%로 다른 정점들의 유사도에 비하여 낮았다. 이외 2020년 4개 정점의 유사도는 80% 이상으로 높은 유사도를 보였다. 2020년 8월 정점 35-11과 36-05간의 유사도가 95.1%로 가장 높은 유사도를 보였다. 2019년 정점 35-15, 36-05는 83%로 높은 유사도를 보였으며, 2019년 정점 36-07과 79%의 유사도를 보였다. 하지만 2019년 정점 36-07은 2019년 정점보다 2020년 정점 35-11과 정점 36-05과 86%로 다른 계절의 조사된 다른 정점과 높은 유사도를 나타냈다.
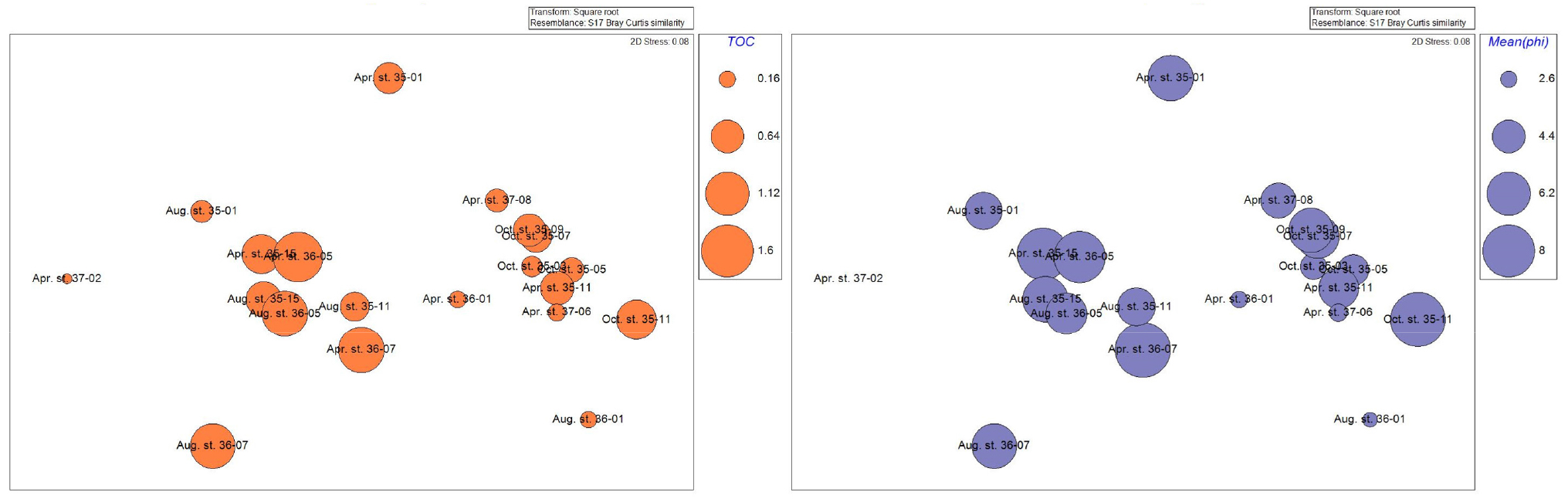
집괴분석결과 유사도와 환경요소에 따른 분포를 확인했다. 그 결과 수심과 수온, 염분도는 큰 영향을 주지 않은 것으로 보였고 입도와 TOC가 집괴분석결과 그룹 간 영향을 주는 것으로 보고 bubble로 나타내어 표현하였다(Fig. 9).
3.8 상관분석
본 연구에서 환경요소로 나타낸 수심, 퇴적물 온도, 염분도, 입도, TOC와 중형저서동물 서식밀도와의 상관관계를 분석하였다(Table 4). 계절별로 총 중형저서동물의 서식밀도 및 우점분류군 5종의 서식밀도의 대한 상관관계를 분석하였다. 2018년에는 중형저서동물의 서식밀도에 수심, 입도, TOC는 양의 상관관계를 보였으며, 퇴적물온도 및 염분도에서는 음의 상관관계를 보였다. 분류군 별로 저서성요각류와 유공충류가 입도 및 TOC에 양의 상관관계를 보인 것으로 나타났다. 다모류의 경우 수심, 염분도와는 음의 상관관계를 보였고, 퇴적물 온도와는 양의 상관관계를 보였다. 2019년에는 2018년과는 다르게 중형저서동물 서식밀도와 염분도와는 양의 상관관계를 보였으며 다른 환경요소와는 음의 상관관계를 보였다. 2019년 저서성 유공충류는 입도 및 TOC와 양의 상관관계를 보였으며, 다른 분류군들은 입도 및 TOC와 음의 상관관계를 보였다. 2020년 8월 퇴적물 온도를 제외한 다른 환경요소들은 중형저서동물 서식밀도와 음의 상관관계를 보였다. 그중 입도는 –0.869로 높은 음의 상관관계를 보였다. 2020년 TOC와 저서성 유공충류만이 양의 상관관계를 보였고 나머지 분류군은 음의 상관관계를 보였다. 입도의 경우 모든 분류군에서 음의 상관관계를 나타냈다.
Table 4.
Correlation analysis of bio-environment at each station during study period
3.9 생물 지수
본 연구에서의 N/C ratio 값은 2.03~120.38의 범위를 나타냈다. 가장 낮은 N/C ratio 값은 2019년 4월 정점 37-02에서 2.03으로 나타났고, 2018년 10월 정점 35-01에서 120.38으로 가장 높은 N/C ratio 값이 나타났다(Table 5).
Table 5.
Comparison of N/C ratio, MPI, ITD at each station during study period
MPI 지수를 이용하여 황해의 계절별, 정점별 오염도를 나타낸 결과로 본 연구의 MPI는 0.16~0.66의 범위를 나타냈다. 가장 낮은 MPI 값은 2019년 4월 정점 35-01에 0.16로 나타났고, 2020년 8월 정점 36-01에 0.66으로 가장 높은 MPI를 나타났다. 평균 0.48을 나타냈는데, 연도별 MPI는 2018년 10월 0.52, 2019년 4월 0.47, 2020년 8월 0.47로 나타났다.
ITD 지수는 평균 0.34으로 0.22~0.60을 보였으며, 가장 높은 값을 보인 정점은 2019년 4월 정점 36-07에서 0.60로 나타났다. 반면 가장 낮은 ITD을 나타낸 정점은 2018년 10월 정점 35-03에서 0.22로 나타났다. 연도별 ITD는 2018년 10월 0.29, 2019년 4월 0.35, 2020년 8월 0.36으로 나타났다.
4. 고 찰
4.1 서식 환경
중형저서동물의 서식밀도에 영향을 미치는 환경요인에는 온도, 입도, 퇴적물 내 유기물의 양, 저질 간극의 공간, 간극수 내의 산소량 등이 있다(Sandulli and De Nicola, 1990; Nybakken, 2001). 이 중 퇴적물 입도는 저서 동물의 분포에 영향을 미치는 중요한 요인이다(Warwick and Buchanan, 1970). 황해는 주변 강들로부터 유입되는 담수와 함께 진흙과 모래가 유입되며, 이러한 퇴적 활동으로 인하여 황해 저층 퇴적물의 구성이 변경된다고 알려져 있다(Grémare et al., 2002). 이는 연도별 퇴적물 입도와 중형저서동물 서식밀도와의 상관관계에서 2018년은 양의 상관관계에서 2019년, 2020년은 음의 상관관계가 나타났다(Table 4). 이처럼 황해의 퇴적상이 변함에 따라 중형저서동물의 군집구조 또한 계절 및 연도별 차이에 영향을 받았음을 나타낸다.
황해의 퇴적상은 전반적으로 근해 지역은 사질 퇴적상을 가진 반면, 중앙역으로 갈수록 니질 퇴적상의 비율이 증가하였다(Table 2). 비교적 니질의 비율이 높은 2019년 3정점(35-1, 36-5, 36-7)을 비교했을 때, 연안인 35-1 정점의 경우 니질의 비율이 30.9, 중앙인 정점 36-5가 49.1, 외해역인 정점 36-7이 59.1로 연안에서 중앙역, 외해역으로 갈수록 니질이 높게 나타났다. 해당 3정점의 중형저서동물 군집을 비교해본 결과, 연안 정점인 35-1에서 선충류의 비율이 98%로 매우 높았으며, 외해역으로 갈수록 다른 분류군의 중형저서동물 비율이 높아졌다. 이중 저서성 유공충류의 경우 외해역으로 갈수록 높아졌으며, 2019년, 2020년 모두 동일하게 나타나 황해의 니질 퇴적상의 대한 중형저서동물 군집의 변화를 확인할 수 있었다. 보다 정확한 연구결과를 위해서는 보다 많은 정점에서 연구를 진행할 필요가 있을 것으로 보인다.
총 유기물 함량(TOC)은 2019년과 2020년 모두 조사가 진행된 6개 정점에 대해 비교를 진행하였다. 2019년 4월에 평균 0.84에서 2020년 8월에 평균 0.68로 감소하였고, 조사된 6개 정점 모두에서 퇴적물 내 유기물 함량이 감소하여 퇴적물 입도의 감소와 유사한 경향을 보였다. 입도와 총 유기물 함량에 대한 분석 결과는 황해가 현재에도 퇴적상이 지속적으로 변화하고 있음을 나타낸다. 3계절 모두 조사가 진행된 정점 35-11의 입도와 총 유기물 함량은 모두 가을, 봄, 여름 순으로 감소하였으며 계절에 따른 차이를 보였다(Table 2). 이러한 경향이 갖는 의미를 고찰하기 위해서는, 향후 황해 조사지역 전 정점에서 지속적인 추가 연구를 통해 모든 계절 및 연간 변화에 대한 확인이 필요할 것으로 보인다.
수심은 중형저서동물의 서식에 미치는 중요한 환경요소이다(Soltwedel, 2000). Vanaverbeke(1997)의 연구에서는 수심 206 m에서 2,760 m까지 수심이 깊어짐에 따라 중형저서동물의 서식밀도가 감소하였으나, 수심의 폭이 비교적 크지 않은 황해를 대상으로 한 Liu et al.(2007)의 연구에서는 중형저서동물 서식밀도가 수심과 유의한 상관관계를 보이지 않았다. 본 연구 지역도 수심의 폭이 크지 않았으며, 해당 연구 또한 중형저서동물 서식밀도와 수심은 상관성을 보이지 않았다(p=0.186)(Table 4). 이러한 연구결과가 정점별 수심의 차이가 크지 않아서인지 또 다른 요인이 있는 것인지는 해당 연구의 결과로는 정확한 추측은 어려우며 향후 다각적인 연구와 접근을 통하여 이후 연구가 진행될 필요가 있다고 생각된다.
4.2 중형저서동물 현존량과 군집구조
전체 중형저서동물 서식밀도는 정점별 ‧ 계절별로 다르게 나타났다. 본 연구에서 중형저서동물 서식밀도는 모든 정점에서 45~1029 inds./10 ㎠범위로 평균 436±69 inds./10 ㎠의 값을 나타내었다(Fig. 2, Table 3). 황해 다른 지역에서의 중형저서동물 연구결과를 보면, 서해 장봉도에서 17~853 inds./10 ㎠, 평균 382 inds./10 ㎠, 백령도 두무진에서 평균 475 inds./10 ㎠, 새만금 외해역에서 22~1759 inds./10 ㎠, 평균 383 inds./10 ㎠ (Min et al., 2003; Kang et al., 2014; Kim et al., 2014)로 보고되었다. 또한 중국 측 황해에서 진행된 중형저서동물 서식밀도가 487~1655 inds./10 ㎠ (Liu et al., 2007)로 나타났다. 황해에서 이전에 조사된 연구 결과들과 비교했을 때, 본 연구에서의 중형저서동물 서식밀도는 기존 연구 결과들과 유사한 범위 내에 있었다.
하지만, 이번 연구의 하지만, 본 연구의 결과만이 갖는 특징으로서 정점 및 계절 간 서식밀도가 다르게 나타났다. 이번 연구를 진행하기 앞서 연안, 중앙역, 외해역의 대한 유사한 경향이 나타날 것이라고 예상하였고, 2019년, 2020년에 정선의 수를 늘려서 연구를 진행하였다. 하지만 연구결과, 각 정점이 가지는 중형저서동물의 서식밀도에는 정선들 간의 경향은 다르게 나타났다. 35,37 정선의 경우 중앙역이 연안과 외해역에 비하여 상대적으로 높은 서식밀도를 나타내었고, 36 정선은 연안이 상대적으로 높은 서식밀도를 나타냈다. 이는 정점 36-01이 다른 연안 정점보다 중형저서동물이 서식하기에 좋은 환경으로, 군산 비응항과 죽도리 사이에 위치한 해당 정점은 만경강에서 유입되는 육상 유기물 및 영양성분의 유입의 영향을 많이 받아 높은 서식밀도를 나타낸 것으로 생각된다. 황해와 같이 수심이 비교적 얕은 북해의 대륙붕에서 진행된 연구에서는 중형저서동물의 서식밀도가 80~2700 inds./10 ㎠였으나 황해는 전체적으로 이보다 더 낮은 서식밀도를 보였다(Heip et al., 1990). 이에 대한 명확한 원인은 본 연구 결과만으로는 정확한 추측이 어려우며, 향후에 장기적이고 다양한 지역과의 비교 분석이 필요할 것으로 사료된다.
이번 연구에서 계절에 따른 중형저서동물의 서식밀도는 2018년 10월 가을에 800±69 inds./10 ㎠, 2019년 4월 봄에 404±51 inds./10 ㎠, 2020년 8월 여름에 260±48 inds./10 ㎠로 가을에 가장 높은 서식밀도를 보였고 다음으로 봄, 여름 순으로 높게 나타났다. 중형저서동물의 군집 분포에 영향을 주는 주요 요인 중 하나로 계절적 변동을 들 수 있는데, 연안에서 중형저서동물의 일반적인 계절적 분포 양상은 여름에 높은 서식밀도를 보이고 겨울철에는 낮은 온도 등의 영향으로 서식밀도가 감소하는 경향을 나타낸다고 알려져 있다(Nybakken, 2001). 반면에 황해 새만금 외해역의 조하대에 진행된 연구의 경우 가을에 383 inds./10 ㎠로 가장 높게 나타났다(Kim et al., 2014). 황해의 조하대에서 진행된 이전 연구와 비교했을 때 가을에 높은 계절적 분포와 동일하게 이전 연구와 같은 결과를 보였다. 계절 간 비교가 가능한 35, 36정선의 6개 정점의 경우 36-01을 제외한 5개 정점은 두 계절 간 서식밀도의 차이가 크지 않거나 춘계에서 더 높은 서식밀도를 보였다. 하계에서 더 높은 서식밀도 차이를 나타낸 36-01 정점은 정선간의 양상에서도 다르게 나타나 해당 지역은 담수로부터 유입이 35-01보다 커 다른 조하대 정점과는 다른 계절적 양상을 나타낸 것으로 생각된다. 하지만 해당 연구에서는 수심과 서식밀도에 명확한 원인은 알 수 없었다. 이는 향후 보다 지속적인 조사를 통한 모니터링이 필요하다고 생각된다.
일반적으로 중형저서동물의 우점 분류군은 선충류, 저서성 요각류, 편형동물, 동문동물, 완보동물, 복모동물 등이며 이들은 대부분의 해역에서 나타나는 것으로 알려져 있다. 이번 황해에서 진행된 2018∼2020년 수행된 3계절에 대한 조사에서는 총 17개 분류군이 출현하였으며, 가장 우점하는 분류군은 선충류, 저서성요각류, 유공충류, 다모류 순으로 나타났다. Kim and Lee(2000)에 의해 시화호 퇴적물에서 조사되어진 중형저서동물 군집 조성 결과에서도 총 11개의 분류군이 출현하였고, Kang et al.(2011)에 의해 서해 장봉도 인근해역에서 진행된 중형저서동물 군집 조성 결과에서도 13개 분류군이 출현하였으며, Shin et al.(2016)에 의해 태안 근소만 갯벌에서 조사되어진 중형저서동물 군집 조성 결과에서도 총 13개의 분류군이 출현하였다. 본 연구에서는 기존의 연구들보다 더 많은 분류군이 출현하였는데, 이는 조간대에 비해 넓은 면적의 조하대 지역에서 조사를 수행하였기 때문에 상대적으로 더 다양한 분류군이 출현하였을 것으로 보인다.
이번 연구에서 우점종인 선충류는 전체 중형저서동물 대비 매우 높은 비율의 서식밀도를 보였으며, 각 정점의 대부분의 시기에서 약 80%이상의 비율을 나타내었다. 선충류는 기존에 국내 연안을 대상으로 한 중형저서동물 군집 연구에서도 모든 시기와 정점에서 가장 우점하는 분류군으로 나타났으며(Kim and Lee 2000; Kang et al., 2011; Shin et al., 2016), 일반적으로 중형저서동물 분류군 중에서 가장 많은 개체수와 높은 종 다양성을 가진 분류군으로 알려져 있다(Nybakken, 2001). 본 연구 또한 국내에서 진행된 다른 연구들과 동일한 결과를 보였다. 계절의 변화에 따른 분류군 수의 변화는 크게 나타나지 않았다. 하지만 정점 35-01은 2019년 5종에서 2020년 10종으로 급증하였다. 이는 패충류(Ostracods), 이매패류(Bivalves), 동문동물(Kinorhynchs), 갑각류 유생(Nauplius) 등 기존에 나타나지 않았던 종들이 2020년에는 출현하였기 때문이다.
본 연구의 중형저서동물 크기 분포는 63 ㎛의 망목을 통과하고 125 ㎛크기의 체에 걸러지는 크기의 개체가 가장 많이 서식하는 것으로 나타났다. 서해안 지역인 새만금 방조제 해역과 장봉도 해역에서 조사된 중형저서동물 군집 연구 결과에서도 63 ㎛의 망목을 통과하고 125 ㎛크기의 체에 걸러지는 크기 개체가 가장 많이 서식하는 것으로 나타났다(Kang et al., 2011). 계절에 따른 중형저서동물의 크기별 분포에서 가장 우점하는 선충류(Nematodes)가 대부분의 기여를 하였고, 크기 분포에서도 국내에서 진행된 다른 연구들과 동일한 결과를 보였다.
해당 연구에서 퇴적물의 깊이에 따른 중형저서동물의 서식밀도는 0~1 ㎝에서 191±45 inds./10 ㎠, 1~2 ㎝에서 151±35 inds./10 ㎠, 2~3 ㎝에서 88±21 inds./10 ㎠로 퇴적물 표층으로부터 깊이가 깊어짐에 따라 감소하였다. 이와 같이, 퇴적물 표층으로부터 그 깊이가 깊어짐에 따라 중형저서동물의 서식밀도가 서서히 감소하는 것은 먹이의 분포, 용존산소량, 공극률 등이 깊이가 깊어짐으로 감소하는 환경적 요인으로 알려져 있으며(Danovaro, 1996; Giere, 2008), 해당 연구결과 일반적으로 중형저서동물에서 보이는 양상과 유사하게 나타났다.
SIMPROF test에 의해 구분된 A Group과 B Group은 동일 정점이더라도 조사 시기가 달라짐에 따라 다른 그룹에 속한 경우도 있었으며, 다른 계절의 다른 정점 간 유사도가 동일 계절의 정점보다 높은 경우도 있었다. 하지만 두 그 룹은 입도와 총 유기물 함량에서 구분되었다. A Group의 총 유기물 함량은 0.16~0.94로 평균 0.42인 반면, B Group의 유기물 함량은 0.06~1.46로 평균 0.85로 A Group보다 2배 이상 높게 나타났다(Table 2). 또한 퇴적물 입도분석 결과 A Group의 10개 정점은 2.5~8.7로 평균 4.7의 입도로 세립사(fine sand)부터 중립실트(medium silt)까지의 입도를 보인 비교적 큰 입자의 퇴적물로 구성된 반면, B group의 경우 –0.3~8.8까지 평균 5.9의 입도로 극조립사(very coarse sand)부터 점토(clay) 퇴적상까지의 다양한 퇴적상이 나타났고, A group의 비해 비교적 작은 입자로 구성되어 있었다. 이처럼 유기물 함량 및 퇴적물의 입도에서는 두 그룹 간 다르게 나타났다(Fig. 9). 하지만 이외 수심, 염분, 수온에서는 두 그룹 간에 차이가 크게 나타나지 않거나 상관관계를 찾지 못하였다(Table 4). SIMPROF test 및 MDS 결과를 통해서도 해당 연구만으로는 명확한 계절 및 정점 간 유사도를 단정할 수는 없었으며 보다 정확한 결과를 위해서는 주기적인 조사와 장기적인 모니터링이 필요할 것으로 사료된다.
4.3 중형저서동물 오염도 지수
최근 중형저서동물을 이용한 환경평가 방법에 대한 관심이 증가하고 있다(Sandulli and Nicola-Giudici, 1990). 일반적으로 해양 저서생태계에서 서식하는 중형저서동물의 조성비는 선충류와 저서성 요각류가 다른 분류군에 비하여 높게 나타나는 경향을 보이며, 본 연구에서도 높은 비율로 나타난 선충류와 저서성 요각류를 이용한 N/C ratio 분석을 수행하였다. 특히 저서성 요각류는 중형저서동물 분류군 내에서 다른 분류군들에 비하여 환경변화에 민감하며(Hargrave and Thiel, 1983; Warwick and Clarke, 1991; Coull and Chandler, 1992), 연구 지역의 오염도와 비례하여 개체수의 급격한 차이를 보이는 대표적인 분류군으로 알려져 있다(Raffaelli and Mason, 1981; Sandulli and Nicola-Giudici, 1990). N/C ratio를 활용한 연구결과 중 새만금 외해역 지역의 연구에서의 N/C ratio 값이 0.02∼87.40의 범위를 보였으며(Shin et al., 2019), 강화만 주변의 평균 N/C ratio 값이 0.2~36.3의 값을 보였다(Kim et al., 2000). 본 연구에서는 N/C ratio 값의 범위가 2~120로 나타냈으며, 2019년 정점 35-01의 경우 120.38으로 높게 나타나고, 이 정점을 제외한 정점들에서는 2.03~34.17로 비교적 낮은 수치를 보였다. 황해와 연결된 보하이해에서 진행된 연구에서는 3.13~160.75로 나타났다(Liu et al., 2015a). N/C ratio가 나타내는 오염도로만 보았을 때 황해와 연결되어 있지만 상대적으로 더 폐쇠적인 지역인 보하이해의 비해 황해의 오염도가 더 낮은 것을 알 수 있다. 광양만에서 진행된 연구의 경우 4~ 686의 N/C ratio를 나타내었는데, 만의 안쪽 정점이 만의 입구정점 보다 20배 높은 값을 나타내었다(Lee et al., 2016). 이번 연구가 연안에 근접한 지역보다는 N/C ratio에서 낮은 오염도를 보이긴 하였으나 보다 넓은 범위에서 진행된 이번 연구에서 대한민국을 기준으로 N/C ratio는 전반적으로 연구지역의 외해역으로 갈수록 오염도의 수치는 증가하는 경향을 나타냈다. 단정할 수는 없지만 육지를 통해 연안에 유입되는 영양성분 및 오염물질이과 같은 외해역까지 영향을 줄 수 있음을 시사합니다.
Yuan et al.(2012)의 황해 해역에서 연구한 중금속 오염도와 현 지수를 비교하였다. 해당 연구정점과 이번 연구의 정점이 유사한 2019년의 5개 정점(St.35-11, St.35-15, St.36-5, St.37-6, St.37-8)의 대하여 지수의 값과 Al, Fe, Cu, Mn, Cd, Hg 6개 항목을 비교한 결과 Al, Fe, Cu의 수치가 높을수록 N/C ratio가 높게 나타났고, Cd의 값이 높을수록 MPI와 ITD는 증가하였다(Yuan et al., 2012). 반면 지수 간의 양상이 다른 것에 대하여 해당 연구만으로는 명확한 원인을 단정할 수 없었다. 하지만 이를 토대로 이후 연구에서는 황해의 전반적인 오염 원인과 이를 뒷받침하는데 유의미한 자료가 될 것이다.
일반적으로 중형저서동물의 군집의 변동 특성을 연구하기 위해서는 장시간 모니터링 조사를 통한 연구 자료가 요구되나, 본 연구에서는 3년 동안 연간 1회(2018년 10월, 2019년 4월, 2020년 8월)의 조사 자료와 일부 환경 자료를 이용하여 군집의 특성을 분석하였기에 본 해역의 중형저서동물 특성을 정확하게 이해하기에는 어려움이 있다. 황해의 중형저서동물의 군집 특성을 보다 정확하게 알고자 향후 추가적인 모니터링 조사 활동과 다양한 환경요인의 측정이 요구되며 본 자료는 황해 저서생태계를 연구하는데 중요한 기초자료로 활용될 수 있을 것이다.