1. 서 론
2. 재료 및 방법
2.1 연구 해역
2.2 환경 특성
2.3 식물플랑크톤 다양성
3. 결 과
3.1 연구 해역의 환경 특성
3.2 3 µm 이상 크기의 식물플랑크톤 군집 분포
3.3 초미소식물플랑크톤의 군집 분포
4. 고 찰
4.1 크기에 따른 식물플랑크톤 군집 특성
4.2 우점 식물플랑크톤
4.3 식물플랑크톤 군집의 계절 변동
1. 서 론
연안 해역은 육지로부터의 물질 유입, 용승, 얕은 수심에 따른 저층으로부터 무기물 공급 등으로 매우 높은 생산성을 나타내 어류를 포함한 다양한 생물들의 먹이를 공급하며 서식처로서 역할을 하고 있다(Hedges et al., 1988; Crossland et al., 2005; UNEP, 2006). 연안은 매립, 항만 건설, 연안침식 등의 인위적이거나 자연적인 환경 변화 요인이 증대됨에 따라 지속 가능한 해역 이용을 위한 연구들이 수행되었다. 최근에는 기후변화 등의 영향에 따라 해양 환경 및 생태계의 변동을 관측 추적하고 변화를 예측함으로써 기후변화에 대응하고 적응하기 위한 연구 필요성이 대두되었으며, 그 하나로 우리나라는 국가해양생태계 종합 조사를 통해 연근해에서 해양 측정망을 구축하고 연 1~2회 조사를 수행하고 있다. 그러나 온대 해역의 폭 넓은 계절 변동성과 생태계 요소의 자연 변동성을 고려하면 해양 환경 변화에 따른 생태계의 변동을 파악하기 위해서는 훨씬 더 정밀한 시간 규모의 자료 축적이 필요하다.
부산항은 1876년 개항 이후 우리나라와 외국의 해상 교통의 관문으로 기능을 수행해왔으며, 세계 2위 환적항으로서 동북아 항만의 중심에 서있다. 최근에는 제2신항 확장 계획과 더불어 부산항 북항 2단계 항만재개발사업을 통하여 부산항을 국제관문도시 및 해양관광도시로 발돋움시키고자 계획하고 있어 개발에 따른 환경 교란에 대응하기 위한 선제적인 연구가 필요해 보인다. 이전에 부산항 개발과 관련하여 부유물질에 의한 생태계 변동 연구(Maritime and Port Authority, 1991) 및 현미경을 통한 식물플랑크톤 군집의 변동(Kim et al., 2005; Baek et al., 2010, 2011, 2019; Jang et al., 2016) 연구 등이 수행된 바 있으나, 대부분 계절 조사에 한정되어 짧은 시간 규모의 변이를 파악하는데 한계가 있었다. 한편 최근에 비약적으로 발달한 분자생물학적 기법은 현미경 보다 더 객관적인 자료를 생성할 수 있으나, 이 방법을 이용한 식물플랑크톤 군집의 시계열 변동 연구는 거의 수행된 바 없다.
해양 생태계 군집 조성의 변동을 이해하기 위한 해외 연구도 대부분이 계절 변동 혹은 단기간의 시계열 변동에 대하여 주로 수행되었으며(Alonso-Sáez et al., 2007; Kim et al., 2014; Needham and Fuhrman, 2016), 장기간의 단기 규모의 변동 연구는 매우 드물다(Teeling et al., 2012). 특히 온대해역은 계절에 따라 해양 환경 및 생물이 큰 영향을 받기 때문에, 장기적 연속 관측을 통한 해양 생태계 변동 자료를 축적하는 것은 해양 생태계 변화를 파악하고, 미래 기후 변화에 따른 변동을 예측하여 대응 방안 수립에 매우 중요할 것이다.
본 연구는 부산항 주변 해역의 연안 고정 지점에서 1년 이상 3 µm 이상 크기의 소형-및 미소식물플랑크톤, 그리고 3 µm 이하 크기의 초미소식물플랑크톤의 군집 구조를 일주일 간격으로 조사함으로써 연안 내만에서 식물플랑크톤 군집의 시계열 변동 특성을 정밀하게 관측하고, 이를 통해 연안 인접 해역에서 나타나는 식물플랑크톤 군집의 단기 변동 특성을 이해하고자 하였다.
2. 재료 및 방법
2.1 연구 해역
본 연구는 2019년 2월 13일부터 2020년 3월 25일까지 매주 58회 조사를 진행하였다. 2019년에는 부산 영도구의 한국해양대학교 부근 지점(KMOU, Fig. 1)에서 시료를 채취하였으며, 2020년부터는 해양박물관 부근 지점(KNMM, Fig. 1)에서 시료를 채취하였다. 두 정점의 수심은 각각 약 7 m와 3 m로 얕았다.
2.2 환경 특성
해역의 수온, 염분 및 밀도의 수직 변화는 Sea-Bird 19Plus CTD (Sea-bird Electronics, WA, US)를 이용하여 측정하였다. 해수 시료는 5 L Niskin 채수기를 이용하여 약 1 m 깊이에서 채수하였으며, 시료의 처리는 채수 후 30분 이내에 실험실로 이동하여 수행하였다. 엽록소 a 는 0.5 L의 시료를 GF/F 여과지에 여과하고 95% acetone으로 하루 정도 추출한 후 형광분석기(10AU fluorometer; Turner Designs, CA, US)를 이용하여 측정하였다(Parsons, 2013). 총 엽록소 a (TChl-a)와 초미소식물플랑크톤의 엽록소 a (PChl-a) 농도는 각각 해수 원액과 3 µm 크기의 폴리카보네이트 여과지를 통과한 해수에서 측정하였다.
2.3 식물플랑크톤 다양성
소형 및 미소식물플랑크톤과 그 이하의 초미소식물플랑크톤을 나누기 위해 3 µm의 공치수를 갖는 폴리카보네이트 막여과지(GVS Filter Technology, Roma, Italy)를 이용하였다. 소형 및 미소식물플랑크톤은 3 µm 여과지에 농축하였으며, 초미소식물플랑크톤은 3 µm 여과수를 다시 0.2 µm Supor® PES (Pall Corporation, NY, US)에 여과하여 농축하였다. 여과한 여과지는 1.5 mL cryovial에 즉시 넣고 1 mL의 STE 완충용액(100 mM NaCl, 10 mM Tris-HCl, 1 mM EDTA, pH 8.0)을 넣어 -80°C에 냉동보관 하였다. DNA의 추출을 위해 Somerville et al.(1989)의 방법을 참조하여 lysozyme (5 mg/mL; Sigma, MO, United States)을 넣고 37°C에서 30분, sodium dodecyl sulfate (Sigma, MO, United States) 및 proteinase K (Qiagen, Hilden, Germany)를 넣고 55°C에서 2시간동안 배양하여 미생물 세포를 용해시켰다. 용해된 샘플에 phenol-chloroform- isoamyl alcohol (25:24:1; Sigma, MO, United States) 0.5 mL 넣고 약 1분간 부드럽게 반복적으로 뒤집어 여과지를 녹이고 혼합한 후 5분간 13,000 ×g로 원심분리하고 상등액 1 mL을 분리하였다. 이과정을 한번 더 반복한 후 분리한 상등액 0.5 mL에 0.5 mL의 isopropyl alcohol (Sigma, MO, United States)과 sodium acetate (Sigma, MO, United States) 70 µL를 넣어준 후 서서히 뒤집어 혼합하였다. 이후 시료를 DNA 정제용 spin 컬럼(Biofact, Daejeon, Korea)에 넣고 원심분리하여 모은 후, 각각 AW1과 AW2 용액(Qiagen, Hilden, Germany)을 넣고 원심분리하여 불순물을 제거하였다. 마지막으로 70°C의 AE 용액(Qiagen, Hilden, Germany)을 넣고 DNA를 회수하였다.
식물플랑크톤 색소체의 16S rRNA 유전자의 V3-V4 (hypervariable) 구역의 증폭을 위하여 PLA491F (5'-CCGGAATA AGTCGGGGTAAC-3')와 PLA907R (5'-CCGTCAATTCMTTTTT-3')을 사용하였으며, Takara Ex Taq (Takara, Shiga, Japan)을 이용하여 증폭시켰다. 증폭된 PCR 산물은 AMPure XP beads (Beckman Coulter, CA, United States)를 이용하여 정제하였으며, 이 산물을 이용하여 MiSeq sequencing을 위한 indexing PCR을 진행하였다(Illumina, 2013). 두 번째 PCR이 완료된 후 두 번째 정제를 실시하였으며, 정제된 산물은 Nanodrop 1000 spectrophotometer (Thermo Scientific, MA, United States)를 이용하여 정량하였다. 동량의 PCR 산물을 한 튜브에 모은 후 천랩(Seoul, Korea)에서 Illumina MiSeq 2 × 300 PE platform을 이용하여 염기서열을 얻었다.
얻어진 염기서열은 Choi et al.(2016)의 방법을 이용하여 분석하였다. 염기서열 분석은 Mothur 프로그램을 이용하였으며(Schloss et al., 2009), 분석과정은 표준분석프로토콜(http://www.mothur.org/wiki/MiSeq_SOP)을 참조하였다(Kozich et al., 2013). 먼저 양방향에 얻어진 reads로부터 contig를 만든 후, 400~525 bp 범위의 길이를 가지며, homopolymers가 8 이하인 contigs를 선택하였다. 염기서열 배열(alignment)은 Silva 데이터베이스(SSURef_NR99_119_SILVA_14_07_14_opt.arb)를 참고서열로 사용하였으며, 이후 염기서열 간에 최대 4 base의 차이를 허용한 pre.cluster 명령어를 이용하여 PCR 오류를 최소화하였다. Chimera 시퀀스는 chimera.vsearch를 이용하여 제거하였으며, 99%의 이상의 시퀀스 유사도를 갖는 시퀀스들을 하나의 operational taxonomic units (OTUs)로 정의하였다. 각 OTU는 80% bootstrap 값 이상의 옵션에서 naïve Baysian classifier를 이용하여 계통분류학적 분석을 수행했다(Wang et al., 2007). 각 시료에서 얻어진 리드(reads)의 수는 3 µm 이상 크기의 식물플랑크톤에서는 3,308에서 37,740개, 초미소식물플랑크톤에서는 3,821에서 33,851개까지 나타나, 시료에 따라 큰 차이를 보였다. 리드 숫자에 따른 군집조성의 차이를 최소화하기 위해 각각 최소값인 3,308 및 3,821으로 시퀀스를 재추출하여 시료간 리드 수를 동일하게 한 후 이후의 분석을 진행하였다. 본 연구에서 얻어진 리드는 NCBI의 SRA 데이터베이스에 등록(3 µm 이상 크기의 식물플랑크톤: accession no. SRR1337032~SRR13370089, 초미소식물플랑크톤: accession no. SRR13404814~13404870)하였다.
3. 결 과
3.1 연구 해역의 환경 특성
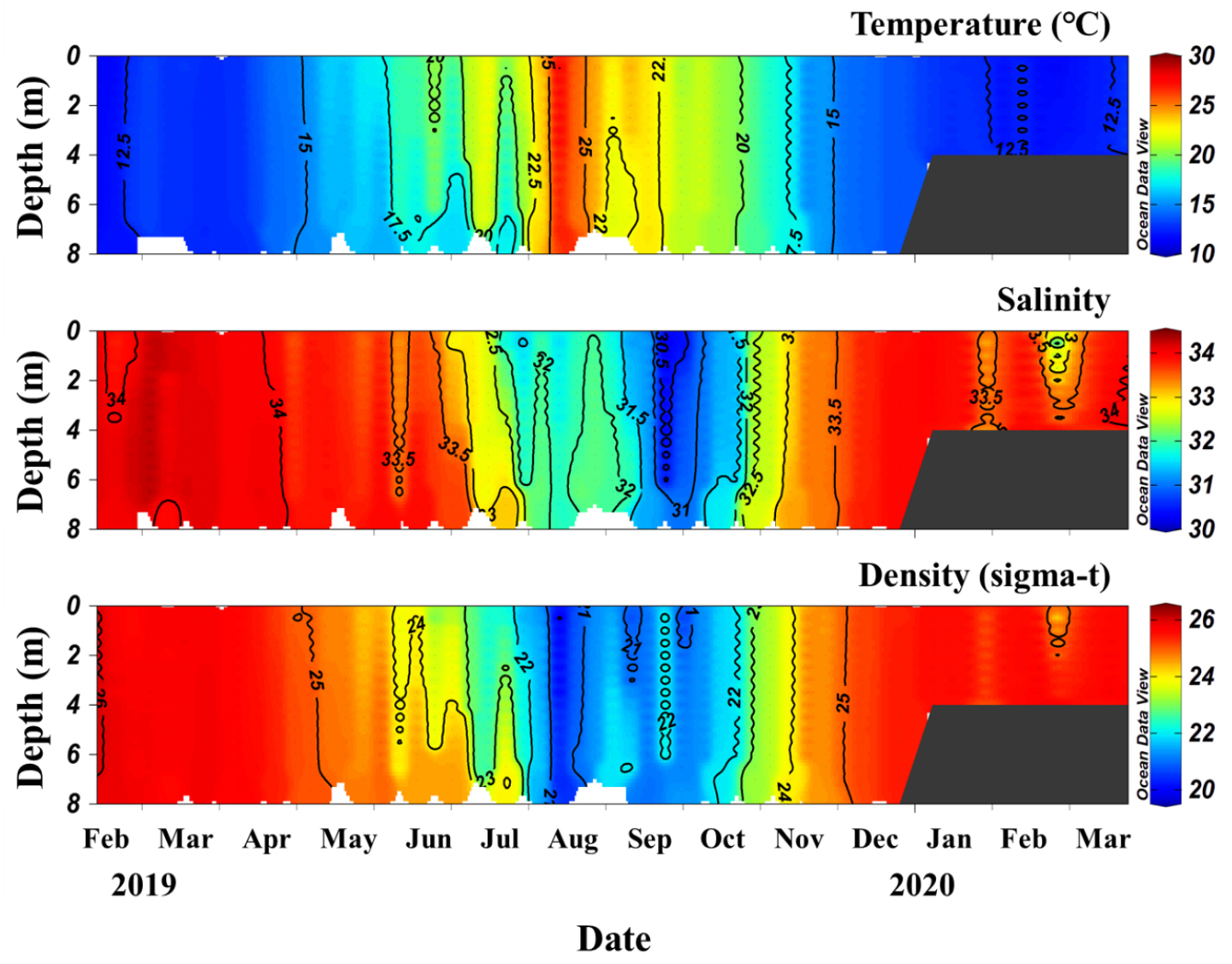
연구해역은 온대해역의 특성을 잘 나타냈다. 수온은 11.5°C~27.6°C까지 변화하였으며, 평균 수온은 16.7°C였다(Fig. 2). 염분은 30.3~34.2의 범위를 보였으며, 평균 염분은 33.1로 나타났다. 6~11월 사이에 수온은 크게 증가하다 감소하였으며, 염분은 반대로 낮아지다 높아지는 반대의 패턴을 보였으나, 그 밖의 기간에는 비교적 좁은 범위의 변동이 나타났다. 본 연구 정점에서 수직적 성층은 뚜렷하게 발달하지 못하였는데, 이는 주로 얕은 수심에 기인한 것으로 여겨진다.
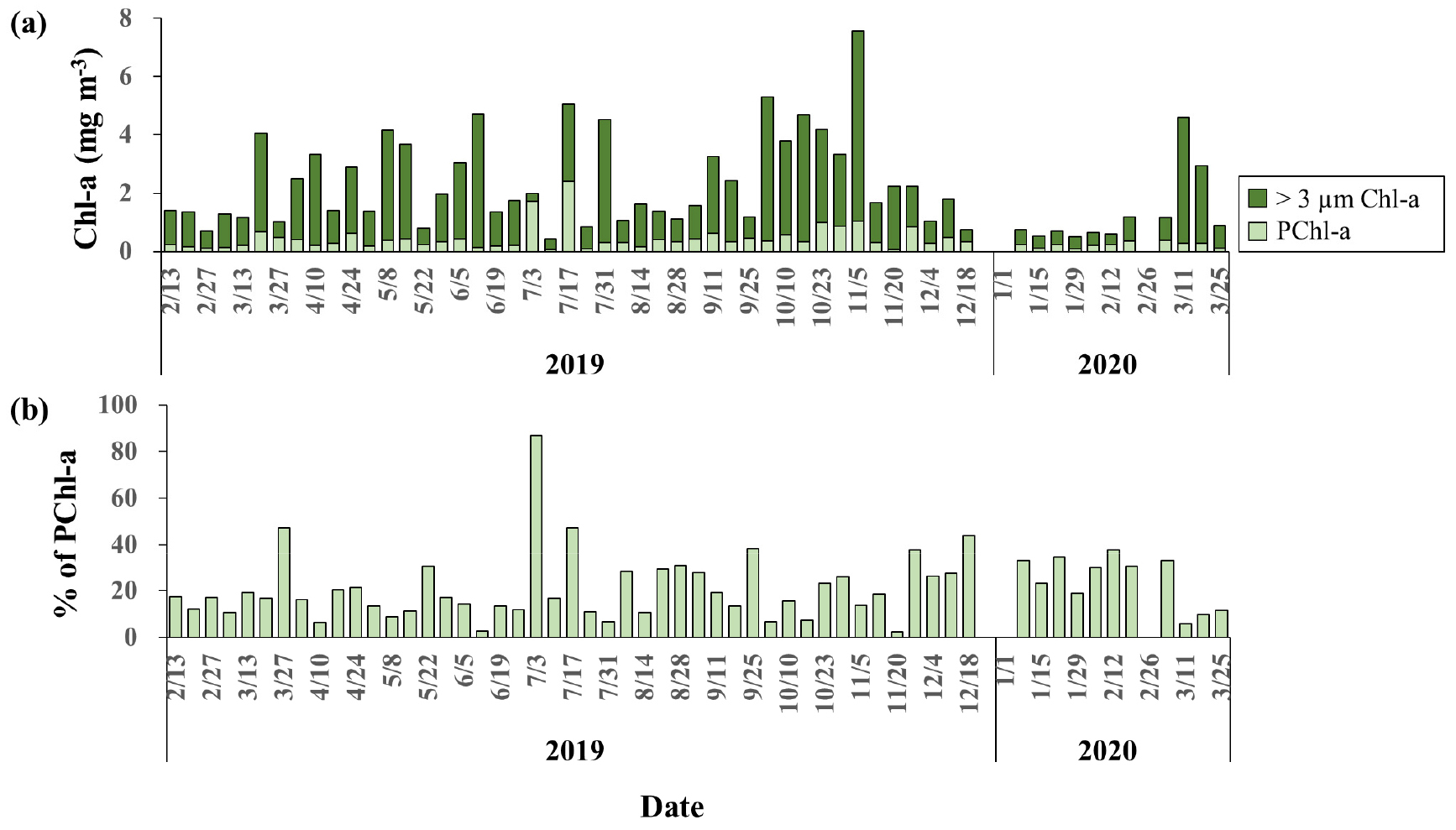
TChl-a는 0.43~7.58 mg m-3 범위에서 나타났으며 비교적 큰 변이를 보였다(Fig. 3). TChl-a는 동계에 상대적으로 낮은 수치를 나타낸 후 봄철 대증식 기간을 거치며 증가하였다. 이후 하계에 접어들며 감소하는 경향을 보였으며, 가을 번성기에 가장 높은 값을 보인 후 동계에 다시 낮아졌다.
PChl-a 농도는 0.05~1.72 mg m-3 범위에서 나타났으며 TChl-a와 유사한 계절 변동 양상을 나타내었다. 연중 PChl-a의 기여도는 평균(± 표준편차) 19.9 ± 12.8%로 나타났으며, 계절적 변동은 크지 않았으나, 여름과 겨울에 다소 높은 경향을 보였다.
3.2 3 µm 이상 크기의 식물플랑크톤 군집 분포
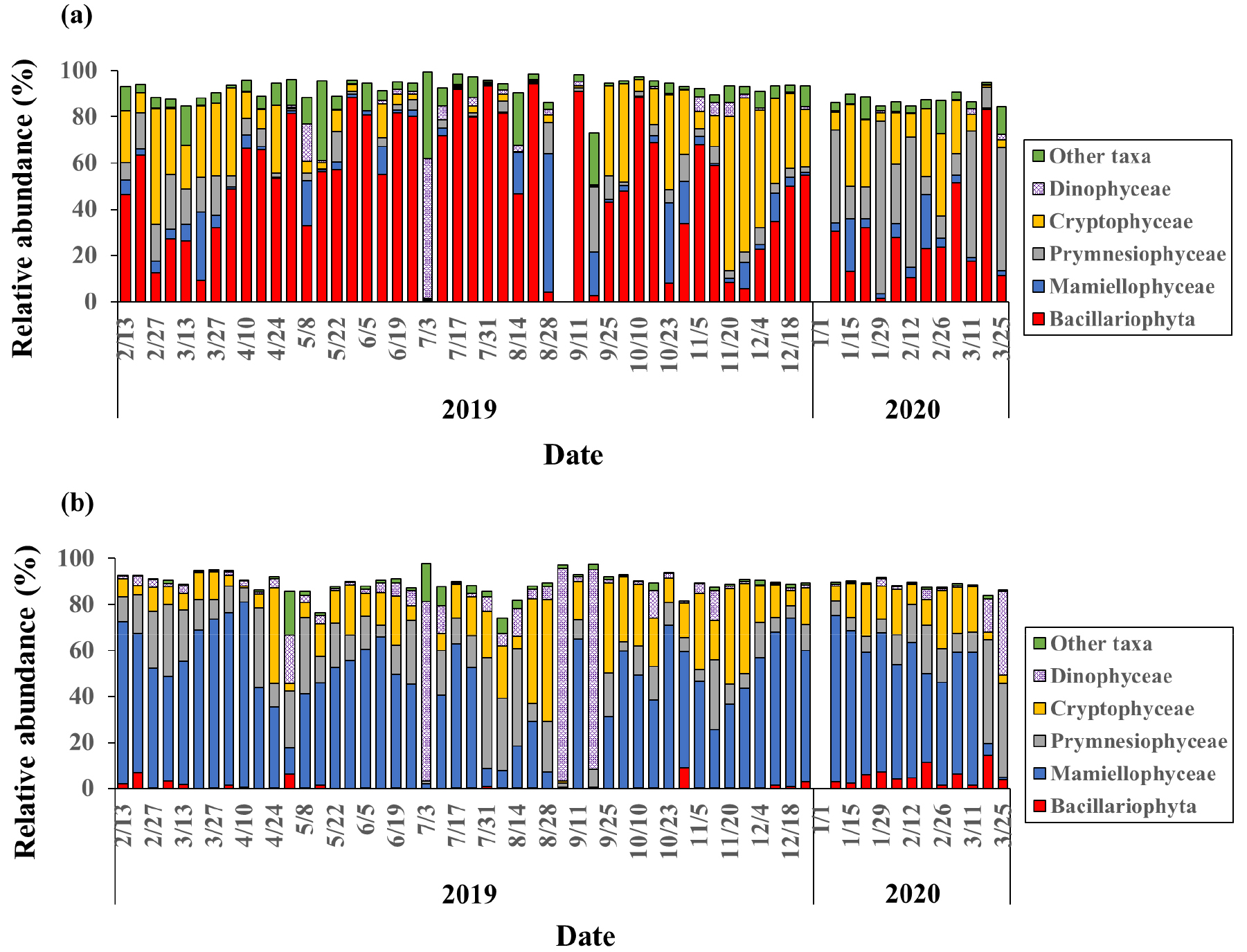
본 연구에서 각 시료의 3 µm 이상의 크기 구배에서 나타난 총 OTU의 수는 각각 33~84 사이로 나타나 연중 큰 변동 특징을 보였다(미제시). 연구해역에서 최소 한번 5% 이상의 점유율을 보인 OTU 수는 18~33 범위로 나타났다. 대부분의 시료에서 규조류(Bacillariophyta)가 46.3 ± 29.0%로 가장 많이 나타났으며, 나머지는 17개의 다양한 강에 속하였다. 강 수준에서 대체로 우점하는 식물플랑크톤 그룹의 종류는 뚜렷한 계절적 차이를 보이지 않았으나, 상대적 비율은 계절에 따라 크게 변동하였다(Fig. 4). 규조류는 춘계 대번성기인 4월부터 10월까지 60% 이상의 높은 점유율로 우점하였으나, 그 외 기간에는 10% 이하로 낮게 나타났다. 규조류가 감소하는 시기에는 은편모조강(Cryptophyceae)이 우점하였으며, 후각편모강(Prymnesiophyceae)도 점유율이 증가하는 경향을 보였다. 그 외 마미엘라강(Mamiellophyceae)과 와편모조강(Dinophyceae)은 기회적으로 우점하는 경향이 나타났다(Fig. 4).
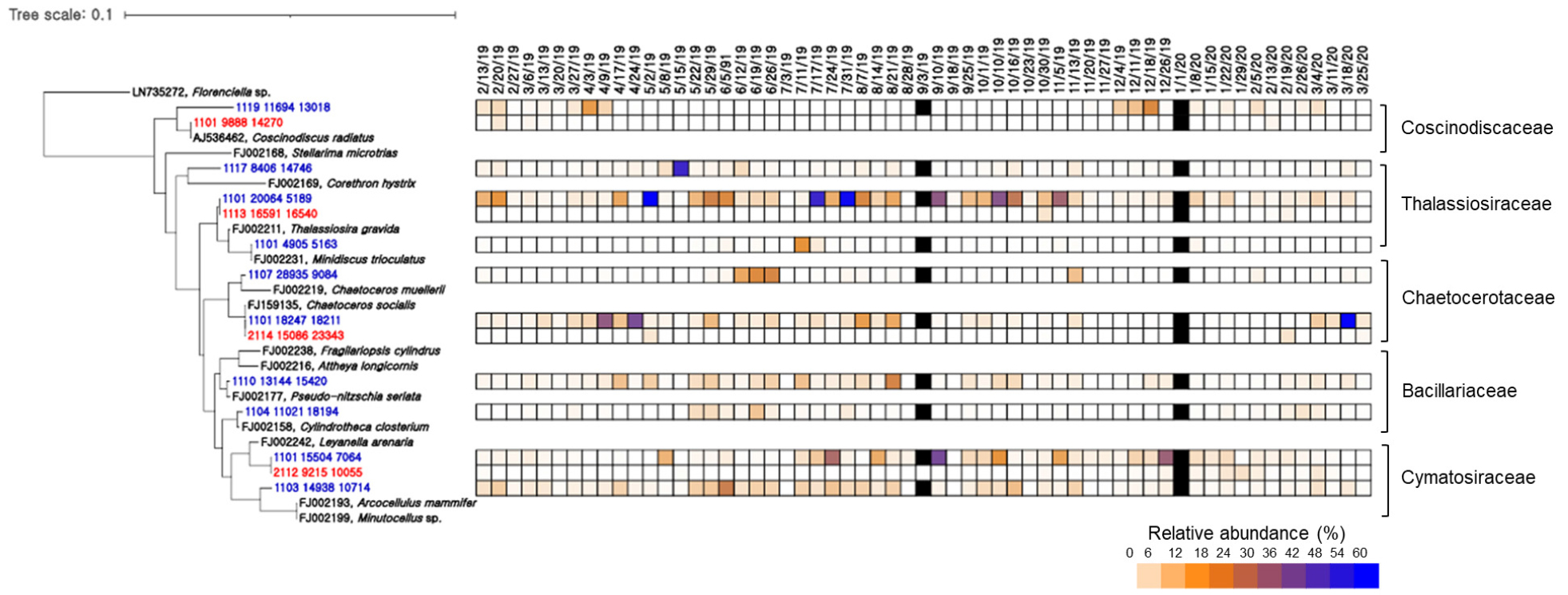
10개의 OTU가 속한 규조류에서 가장 우점하는 OTU들은 Thalassiosiraceae 및 Cymatosiraceae 과에 속하였으며, 관측기간 각각 평균 13.9 ± 15.4% 및 11.8 ± 11.1%씩 나타났다(Fig. 5). 이들 OTU는 유사한 계절 변동 양상을 보여, 5 월과 10 월 사이에 각각 22.0 ± 18.8% 및 16.5 ± 13.4%의 높은 우점도를 보였으나 겨울에는 9% 이하로 감소하였다. Bacillariaceae 과에 속하는 OTU의 점유율은 겨울기간 동안 10% 이하로 비교적 낮았으며 봄과 여름에 최대 30% 이상 다소 증가된 경향을 보였다. Chaetocerotaceae 과에 속한 OTU는 초봄에 높은 우점도를 보였으며, 여름까지 10% 정도로 나타났다. Coscinodiscaceae 과에 속한 OTU는 초겨울부터 봄까지 1~28% 범위로 특정 시기에 비교적 높은 비율로 출현하였으나 봄과 겨울에는 거의 출현하지 않았다.
은편모조강은 연구 해역에서 관측 기간 동안 두번째로 우점하였으며(Fig. 4), 상대적으로 수온이 낮았던 계절에 우점하였다. 그러나, 관측기간 동안 단 하나의 OTU만이 나타났으며, 아직 분류되지 않은 클론의 염기서열과 가장 유사하게 나타났다(Fig. 6).
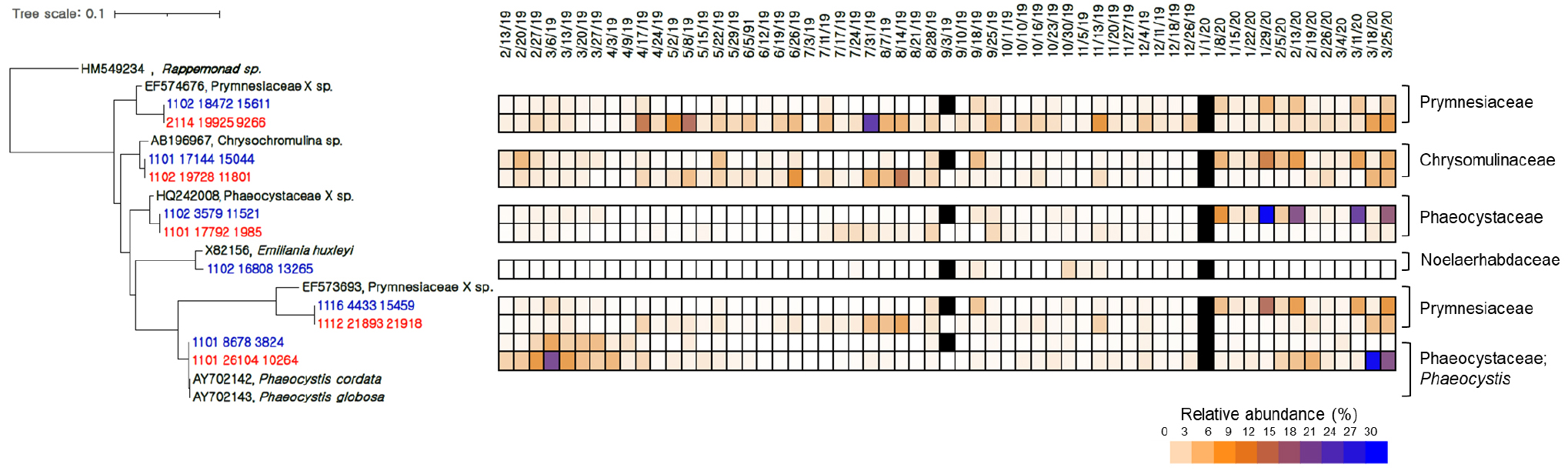
마미엘라강에서는 Micromonas와 유사한 OTU들이 연중 가장 우점하였으며, Ostreococcus와 유사한 OTU는 여름에 일시적으로 나타나는 경향을 보였다(Fig. 7). 후각편모강은 주로 겨울철에 우점하였으며, Phaeocystaceae, Prymnesiaceae 및 Chrysochromulinaceae 과와 유사한 OTU가 관측 기간 동안 가장 우점하였다(Fig. 8). 와편모조강에 속하는 단 하나의 OTU는 여름철에 증가하는 경향이 나타났으며(Fig. 6), 계통분류학적으로 Amphidinium testudo와 유사하게 나타났다.
3.3 초미소식물플랑크톤의 군집 분포
연구해역에서 나타난 3 µm 이하의 초미소식물플랑크톤 군집의 총 OTU의 수는 19~82사이로 나타났으며(미제시), 최소 한번 5% 이상의 점유율을 보인 초미소식물플랑크톤 군집의 OTU 수는 11~20으로 나타났다. 마미엘라강이 연중 45.5 ± 21.8%로 가장 우점하였으며, 은편모조강과 후각편모강도 각각 15.9 ± 12.1%과 15.7 ± 11.2%로 비교적 높은 점유율을 보였다(Fig. 4). 특히 마미엘라강의 우점도가 낮아지는 여름에 은편모조강 및 후각편모강의 우점도가 증가하는 경향이 나타났다. 와편모조강은 연구 기간 동안 상당한 비율(8.3 ± 19.3%)을 차지했으며 여름에 일시적으로 우점하는 양상을 보였다. 3 µm 이상에서 가장 우점한 규조류는 상대적으로 매우 낮은 비율로 나타났으나(2.0 ± 3.0%) 겨울에 약간 증가하였다(Fig. 4).
초미소식물플랑크톤에서 가장 우점하는 강인 마미엘라강은 여름을 제외하면 40% 이상 꾸준히 우점하였다(Fig. 7). 4개의 우점하는 OTU가 마미엘라강에 포함되었는데 Mamiellaceae 및 Bathycoccaceae 과에 속하였다.
후각편모강에 속하는 OTU 중 Phaeocystaceae 과와 유사한 OTU가 겨울에 두드러지게 나타났으며, 이후 여름까지 점차 감소하였다(Fig. 8). 반대로, Prymnesiaceae 과에 속하는 OTU는 여름과 가을까지 증가하는 경향을 보였다. 은편모조강에 속하는 OTU는 단 하나만이 나타났으며(Fig. 6), 이는 작은 은편모조류 속인 Plagioselmis와 유사(유사도 100%) 하였다. 겨울에 다소 증가한 규조류에 속하는 OTU는 Cymatosiraceae 과에 속하였다(Fig. 5).
4. 고 찰
연구 정점에서 거의 모든 시기에 3 µm 보다 큰 크기의 식물플랑크톤이 생체량에 큰 기여를 하였으며, 초미소식물플랑크톤은 대체로 20% 이하의 낮은 생체량을 보였다. 3 µm 보다 큰 식물플랑크톤에서는 규조류 및 은편모조강에 속하는 식물플랑크톤 군집이 우점도를 양분하였으며, 반면 초미소식물플랑크톤에서는 마미엘라강, 은편모조강 및 후각편모강이 우점하여, 두 크기 구배에서 군집 조성은 큰 차이를 나타내었다(Fig. 4). 두 크기 구배 모두 강 수준에서 식물플랑크톤 군집조성은 계절적 변동 특성이 뚜렷하게 나타났다. 더욱이 동일한 강 내에서는 계절보다 더 좁은 시간 규모에서 우점 OTU가 변동하여, 종 수준에서 식물플랑크톤 군집은 매우 빠르게 환경에 반응하여 변화하고 있음을 시사하였다.
4.1 크기에 따른 식물플랑크톤 군집 특성
엽록소 a의 크기 구배 자료로 볼 때 연구해역은 대부분의 시기에 3 µm 이상 크기의 식물플랑크톤이 우점하였다(Fig. 3) 일반적으로 연안 환경에서 하계에 수층의 영양염이 감소하면서 엽록소 a 농도 중 초미소식물플랑크톤의 기여도가 증가한다는 결과(Lee and Yoo, 2016; Agawin et al., 2000; Caroppo, 2000)를 고려하면, 이는 수심이 낮은 내만에 위치한 본 연구 지점이 일반적인 연안과 다소 환경적 차이가 있음을 시사한다. 뿐만 아니라 온대 해역에서 춘계 번성이 추계 번성 보다 훨씬 크게 나타나는데 반해, 본 연구해역에서는 추계에 엽록소 a의 농도가 더 크게 나타났는데, 이러한 차이는 연구 지점이 육지에 인접한 천해역으로 수심이 얕고 육지로부터의 영향을 크게 받아 일반적인 연안과는 다른 생태적 특성을 보인 것으로 여겨진다. 이런 환경적 특성으로 하계에도 성층이 나타나지 않아 영양염이 비교적 높은 수준을 유지하였고 하계에도 춘계와 유사하게 초미소식물플랑크톤 보다는 크기가 큰 식물플랑크톤이 계속 우점할 수 있는 환경이 조성되었던 것으로 여겨진다. 실제로 연구해역에서 얻어진 질산염 농도(미발표 자료)는 하계에 6.7 ± 3.8 µmol/L 로 동계의 8.4 ± 4.0 µmol/L 와 유사한 농도를 유지하였다.
본 연구에서 3 µm 이상 및 초미소식물플랑크톤 군집의 분포 특성은 강 수준에 따라 각각 다르게 나타났다. 3 µm 이상 크기의 식물플랑크톤에서 규조류가 가장 우점한 반면, 초미소식물플랑크톤에서는 녹조류인 마미엘라강이 우점하였다. 하지만 3 µm 이상 크기의 식물플랑크톤이 연구해역의 식물플랑크톤 생체량의 80% 이상을 차지한다는 점에서(Fig. 3) 규조류가 연구 해역의 광합성 및 먹이망 구조의 유지에 중요한 역할을 하고 있음을 시사한다(Fig. 4)
한편, 3 µm 이상의 크기 구배에서도 비교적 높은 마미엘라강과 후각편모강이 나타났다(Fig. 8). 하지만, 두 크기 구배에서 얻어진 식물플랑크톤 OTU의 계통분류학적 분석 결과는 일부 그룹의 경우 실험상의 문제(artefact)에 의해 3 µm 이상의 군집 조성이 왜곡되었을 가능성을 시사하였다. 즉, 크기를 나누기 위해 3 µm 여과지에 여과할 때, 초미소 크기에서 우점하였던 분류군인 마미엘라강과 후각편모강에 속하는 세포가 여과지의 막힘 등으로 3 µm 여과지에 남아 시퀀싱되었을 가능성이 커 보인다(Figs. 7, 8). 실제로 두 크기 구배에서 얻어진 이들 분류군에 속하는 OTU들은 거의 동일한 염기서열을 나타내었는데, 이러한 결과는 앞에서 언급한 실험상의 문제 때문이거나, 실제로 이들 생물들이 3 µm 전후의 크기를 가져 두 크기 구배에서 모두 나타났을 가능성이 있다. 하지만, 지름이 약 0.8 µm 내외로 가장 작은 진핵생물로 알려진 Ostreococcus와 초미소식물플랑크톤으로 잘 알려진 Micromonas에 속하는 시퀀스도 3 µm 이상의 크기 구배에서 나타난 점은 막 여과에 따른 문제가 컸음을 시사한다(Worden et al., 2009; Moreau et al., 2012). 이는 3 µm 이상 크기 구배에서 후각편모강과 마미엘라강의 비율이 상당히 과대평가되었을 가능성이 있으며, 이들 군집이 3 µm 이상 크기의 식물플랑크톤에서 나타났다는 점에 있어서 신중하게 해석할 필요가 있다. 반면, 두 크기 구배에서 얻어진 규조류, 은편모조강, 와편모조강 및 황조강(Chrysophyceae)에 속하는 OTU들은 계통적으로 차이를 나타내어 이러한 오류의 가능성이 낮았다.
4.2 우점 식물플랑크톤
엽록소 a의 평균 80% 정도의 대부분을 차지하는 것으로 나타난 3 µm 이상의 크기에서 규조류가 가장 높은 비율을 차지한 점을 고려하면(Fig. 3), 연구해역에서 규조류가 연중 가장 우점하는 식물플랑크톤인 것으로 보이며(Fig. 4) 이는 우리나라 연안역에서 얻어진 결과들과 일치한다. 현미경을 통한 한국 연안의 식물플랑크톤 군집의 변동 관측 결과 황해 남서해 연안 인접해역에서 규조류는 연중 30% 이상 우점하였으나, 여름철에는 30% 미만으로 낮게 나타났다(Yoon, 1998; Yoon, 2015). 제주 연안 해역에서도 봄철에 규조류가 80% 이상 우점한 후 하계에 50% 이하로 감소하였으며, 규조류의 감소와 동시에 와편모조강이 증가하는 경향이 나타났다(Affan et al., 2007). 색소 분석을 통한 식물플랑크톤 군집의 변동에서는 황해 남서해 연안에서도 역시 규조류가 연중 최우점하는 것으로 보고되었다(Kang et al., 2019). 한편, 황해 남서해 연안에서 은편모조강은 연중 규조류 다음으로 우점하여 본 연구에서도 유사한 경향을 보였으나, 규조류가 10배 이상 높아 은편모조강이 20% 이상의 높은 점유율을 나타낸 본 연구의 결과와 달랐다(Kang et al., 2019). 연안역에서 영양염은 규조류와 같이 상대적으로 큰 크기의 식물플랑크톤에 의해 많이 소모된다고 알려져 있다(Moisan et al., 2017; Cloern, 2018). 본 연구해역은 육지와 매우 인접해있고 육지로부터 유입되는 작은 하천이 존재하며, 매우 얕은 수심으로 구성되어 저층과의 물질 교환이 원활하게 일어나 연구 기간 내내 영양염의 농도가 꾸준히 높게 유지되었을 것으로 보이는데, 규조류의 우점은 이러한 환경 특성과 연관된 것으로 사료된다. 본 연구해역에서 두번째로 우점한 은편모조강은 상대적으로 낮은 수온의 환경을 선호한다고 알려져 있는데(Mendes et al., 2013; Lv et al., 2014; Dame et al., 2000), 본 연구에서 추계 및 동계에 상대적으로 높은 비율을 나타낸 것은 이전의 연구와 일치하였다.
4.3 식물플랑크톤 군집의 계절 변동
기존 연구에서 규조류 내의 종들은 빠른 계절적 변이를 보이는 것으로 보고되었다. 동중국해에서 봄 및 여름에 Thalassiosiraceae, 가을은 Chatocerotaceae 과가 우점하였고 겨울에는 Thalassiosiraceae, Bacillariaceae 및 Chaetoceraceae 과가 함께 우점하는 것으로 나타났으며(Guo et al., 2014), 북부 Baffin 만에서 Chaetoceraceae 과의 번성 이후에 Thalassiosiraceae과의 번성이 나타났다(Booth et al., 2002). 그러나 본 연구해역에서는 Thalassiosiraceae, Cymatosiraceae 및 Chaetocerotaceae과에 속하는 OTU들이 대부분 비슷한 계절에 우점하며 서로 공존하는 특성을 보였다(Fig. 5). 하지만, 같은 계절에도 각 OTU들의 상대적 점유율이 비교적 뚜렷하게 변동하여 좁은 시간 규모의 다양한 환경 및 생물학적 조건의 변화에 적응하여 종 수준의 변동이 매우 활발하게 일어나고 있음을 시사하였다. 반면 Bacillariaceae 및 Coscinodiscaceae 과에 속하는 OTU는 각각 여름과 겨울에 우점도가 증가하는 경향이 나타나 다른 그룹과 차이를 보였다.
은편모조강은 연안역에서 대부분의 계절에 나타나며(Klaveness, 1988), 상대적으로 낮은 수온을 선호하는 군집으로 알려져 있다(Dame et al., 2000; Lv et al., 2014). 본 연구에서도 마찬가지로, 은편모조강은 상대적으로 수온이 높았던 늦봄-여름 보다는 가을-겨울철에 더 많이 우점하는 경향이 나타났다(Fig. 6).
초미소식물플랑크톤에서 가장 우점하는 마미엘라강 OTU는 가장 뚜렷한 계절 변동 특성을 나타냈다(Fig. 7). Mamiellaceae과에 속하는 OTU가 연중 가장 우점하였으며, Micromonas에 속하는 OTU는 겨울과 봄에 우점하였고, Bathycoccus에 속하는 OTU는 상대적으로 여름에 많이 나타났다. 마미엘라강이 전세계 대부분의 연안에서 가장 우점하는 군집으로 알려져 있으며(Tragin and Vaulot, 2018) Micromonas는 상대적으로 영양염이 풍부한 해역에 우점하는 속으로 알려져 있는 점을 고려하면(Guillou et al., 2004; Not et al., 2005, 2008; Foulon et al., 2008), 연구 해역의 비교적 높은 영양염 공급으로 마미엘라강의 성장에 우호적인 환경이 제공된 결과로 여겨진다.
후각편모강에서는 Phaeocystaceae 과에 속하는 OTU가 겨울철에 상대적으로 증가하는 경향이 나타났다(Fig. 8). Phaeocystaceae 과는 육지로부터 비교적 높은 영양염의 유입에 의하여 번성이 일어나며(Cadée and Hegeman, 1991), 비교적 낮은 수온을 선호하는 것으로 알려져 있어 겨울에 연안 환경이 이들 그룹의 성장에 좋은 환경을 제공한 것으로 여겨진다(Hai et al., 2010; Wang et al., 2010). 한편 연안역에서 Phaeocystaceae 과는 N-제한적인 환경을 P-제한적인 환경으로 조절해 주며 번성 후에 규조류의 번성에 도움을 주는 것으로 알려져 있다(Riegman et al., 1992). 본 연구해역에서도 겨울철 Phaeocystaceae 과의 번성 이후 규조류가 우점하는 양상이 나타나 유사하였으나, 영양염 조건 변화 때문인지의 여부는 확실하지 않아 보인다. 한편, 2019년과 2020년 겨울에 모두 나타난 Phaeocystaceae 과 OTU의 우점도는 각각 2~23% 및 3~41% 정도로 약 2배정도 증가하는 양상이 보여 큰 연변화를 보였다. 2020년 겨울이 2019년 겨울보다 상대적으로 수온이 높고 영양염 농도가 높았던 것에 기인하였을 가능성은 있으나 이러한 변이의 원인을 이해하기 위해서는 더 많은 장기 자료의 축적이 필요할 것으로 보인다.
일 년여간 고정점에서 연속적인 관측을 통하여 부산항 주변 천해역의 식물플랑크톤 군집의 계절적 변동 특성을 면밀히 이해할 수 있었다. 연구해역은 얕은 수심으로 일반적인 연안역과는 다르게 성층이 발달되지 않았으며, 추계에 춘계에 비해 높은 엽록소 농도가 나타났다. 우점하는 식물플랑크톤의 종류는 강 수준에서 연중 대체로 유사하였으나, OTU 수준에서는 큰 변이를 보여, 연안역에서 식물플랑크톤이 환경의 변화에 따라 종수준에서 빠르게 적응하여 변동할 수 있음을 보였다. 본 연구의 결과는 부산항 주변 연안 생태계 를 이해하고 기후 및 환경 변화와 개발과정에 있어서 일어날 수 있는 다양한 요인에 의한 생태계의 변동을 평가하기 위한 기반 자료로 활용될 수 있을 것이다.