1. 서 론
2. 재료 및 방법
2.1 고속회전식 수동형 채집 장치
2.2 고속회전식 수동형 채집 장치의 현장 적용
2.3 PAHs 분석
2.4 자유용존상 농도 산출 및 평형도달시간 예측
2.5 QA/QC
3. 결 과
3.1 고속회전식 수동형 채집 장치의 평형도달시간 예측
3.2 존재 형태별 PAHs 농도 분포
3.3 황해 및 남해에서의 PAHs 생물이용가능성
4. 결 론
1. 서 론
소수성 유기오염물질(hydrophobic organic contaminants)은 잔류성, 생물농축, 생물독성의 성질을 가지는 유해물질로, 육지로부터 소수성 유기오염물질의 유입 및 연안에서의 오염은 대기 및 해류로 인하여 외해에 서식하는 생물에까지 축적될 수 있다(Perugini et al., 2007; Kim and Stapleton, 2010; Wang et al., 2019). 소수성 유기오염물질의 생물학적 영향 및 해양에서의 거동을 파악하기 위해서는 해수에서의 화학 자료가 필수적이지만, 오염수준이 매우 낮은 외해에서의 농도를 측정하기 위해서는 100 L 이상 시료가 확보되어야 검출이 가능하고, 분석 시 상당한 노동과 시간이 소요되는 어려움이 있다.
수동형 채집법(passive sampling)은 기존의 일회성 시료 채취법(grab sampling)의 한계를 보완해 줄 수 있는 방법으로, 노출기간 동안 오염물질의 평균화된 농도를 제시할 수 있으며, 낮은 검출한계를 가지므로 pg/L 수준의 초저농도까지 검출 가능하다(Booij et al., 2014; Moschet et al., 2014). 해수에서의 소수성 유기오염물질은 입자상(particulate phase) 또는 용존유기탄소(dissolved organic carbons) 및 콜로이드와 같은 용존상(dissolved phase)에 결합되어있거나, 물속에서 자유롭게 용존되어 있는 자유용존상(freely dissolved phase)으로 존재한다. 해수에서 다양한 형태로 존재하는 소수성 유기오염물질 중 생체막을 통과하여 생물에게 실질적으로 이용되어질 수 있는(bioavailable) 형태는 오로지 자유용존상만 해당된다(ITRC, 2011; USEPA, 2012; Perron et al., 2013). 수동형 채집기(passive sampler)는 용존유기탄소나 콜로이드와 결합되어 있는 거대 분자는 흡수하지 못하고 자유용존상 만을 흡수하기 때문에(Huckins et al., 1990; Vrana et al., 2005), 생물농축 및 해양생태계의 위해성 평가 등에 있어 보다 정확한 자료를 제시할 수 있다(You et al., 2006; Joyce et al., 2015; Ortega-Calvo et al., 2015).
수동형 채집기는 평형 분배의 원리를 이용한 오염물질 포집 장치로서 오염물질이 수동형 채집기와 물 사이에 평형에 도달할 때까지 현장에 노출되어야 한다. 수동형 채집기에 사용된 유기중합체(polymer)의 재질이나 두께 또는 분석대상물질에 따라 평형도달시간이 다르지만, 짧게는 하루에서 길게는 일 년 이상 소요된다(Cornelissen et al., 2008; Apell et al., 2016). 하지만 해양에서 수동형 채집기의 장기간 노출은 부착생물로 인하여 정확한 오염물질의 농도 측정이 어렵다. 긴 노출 시간에 따른 생물부착 문제를 극복하기 위하여 실행보정물질(performance reference compounds, PRCs)를 활용하기 시작하였다(Huckins et al., 2002; Joyce et al., 2015; USEPA, 2017). 실행보정물질로는 환경에는 존재하지 않지만 분석대상물질과 물리화학적 성질이 동일한 화합물이 사용된다. 분석대상물질에 적합한 실행보정물질을 선택하여 고농도로 수동형 채집기에 사전 흡수시킨 후 환경에 노출하게 되면, 평형 분배에 따라 수동형 채집기에서 환경 상으로 점차 빠져나가 감소하게 된다. 이때 실행보정물질이 감소하는 속도는 분석대상물질이 수동형 채집기에 흡수되는 속도와 동일하다는 가정 하에, 남아있는 실행보정물질로부터 분석대상물질의 농도를 예측할 수 있다. 다만 실행보정물질을 이용하여 분석대상물질의 농도를 계산하기 위해서는 수동형 채집기에서의 실행보정물질이 20% 이상 감소되어야 하고(Booij and Smedes, 2010; Apell and Gschwend, 2014), 분석대상물질 역시 검출한계 이상으로 흡수되어야 한다.
본 연구에서는 수동형 채집기 중 소수성 유기오염물질 분석에 적합한 저밀도 폴리에틸렌(low density polyethylene, LDPE) (Cornelissen et al., 2008; Sacks and Lohmann, 2012; Fernandez et al., 2014)을 장착한 프로토타입의 고속회전식 수동형 채집 장치(high speed rotation-type passive sampling device)를 개발하였다. 고속회전식 수동형 채집 장치는 수동형 채집기 주변의 물을 고속으로 회전하여 수동형 채집기 표면에 존재하는 물경계층(water boundary layer)을 감소시켜 빠르게 자유용존상 소수성 유기오염물질을 흡수시킬 수 있도록 제작되었다. 본 연구에서는 소수성 유기오염물질 중 화석연료의 불완전한 연소로부터 발생되거나 유류에 포함된 성분으로 해양에 상시적으로 오염되어있는 다환방향족탄화수소(polycyclic aromatic hydrocarbons, PAHs)를 분석대상물질로 선정하여 첫째, 실행보정물질로부터 고속회전식 수동형 채집 장치의 적절한 현장노출시간을 파악하였고 둘째, 고속회전식 수동형 채집 장치를 남해와 황해에 적용하여 연안 뿐만 아니라 오염수준이 상대적으로 낮은 외해에서의 자유용존상 PAHs 농도를 측정하였다. 셋째, 기존의 대용량 해수 채취법(high volume water sampling)으로 동일 해역에서의 용존상 PAHs 농도를 측정한 후 자유용존상 농도와 비교하여 생물에게 실질적으로 이용될 수 있는 비율을 파악하였다.
2. 재료 및 방법
2.1 고속회전식 수동형 채집 장치
본 연구에서 사용한 수동형 채집기는 25.4 μm 두께의 LDPE (Covalence, Minneapolis, MN, USA) 시트로 50 × 30 cm 크기에 맞게 자른 후 디클로로메탄, 메탄올, 초순수 순으로 3번씩 15분간 초음파(sonication) 추출하여 세척하였다(Lao et al., 2019). 실행보정물질로 사용된 화합물은 acenaphthene-d10 (ACE-d10), phenanthrene-d10 (PHE-d10), perylene-d12 (PER-d12)으로 메탄올:물(80:20, v/v) 혼합용매에 첨가한 뒤 세척한 LDPE를 담궈 교반하면서 1주일간 흡수시켰다(Booij et al., 2002).
고속회전식 수동형 채집 장치는 스테인레스 스틸 본체, 회전 모터, 프로펠러, LDPE 고정 프레임으로 구성되어 있다(Fig. S1). 본체는 약 60 L(직경 40 × 높이 50 cm)로 해수가 밑에서 유입되어 위로 배출될 수 있도록 제작하였으며, 프로펠러의 회전속도는 900 rpm으로 설정하였다. LDPE 시트는 프레임에 장착한 뒤 실리콘 튜브로 고정하였다.
2.2 고속회전식 수동형 채집 장치의 현장 적용
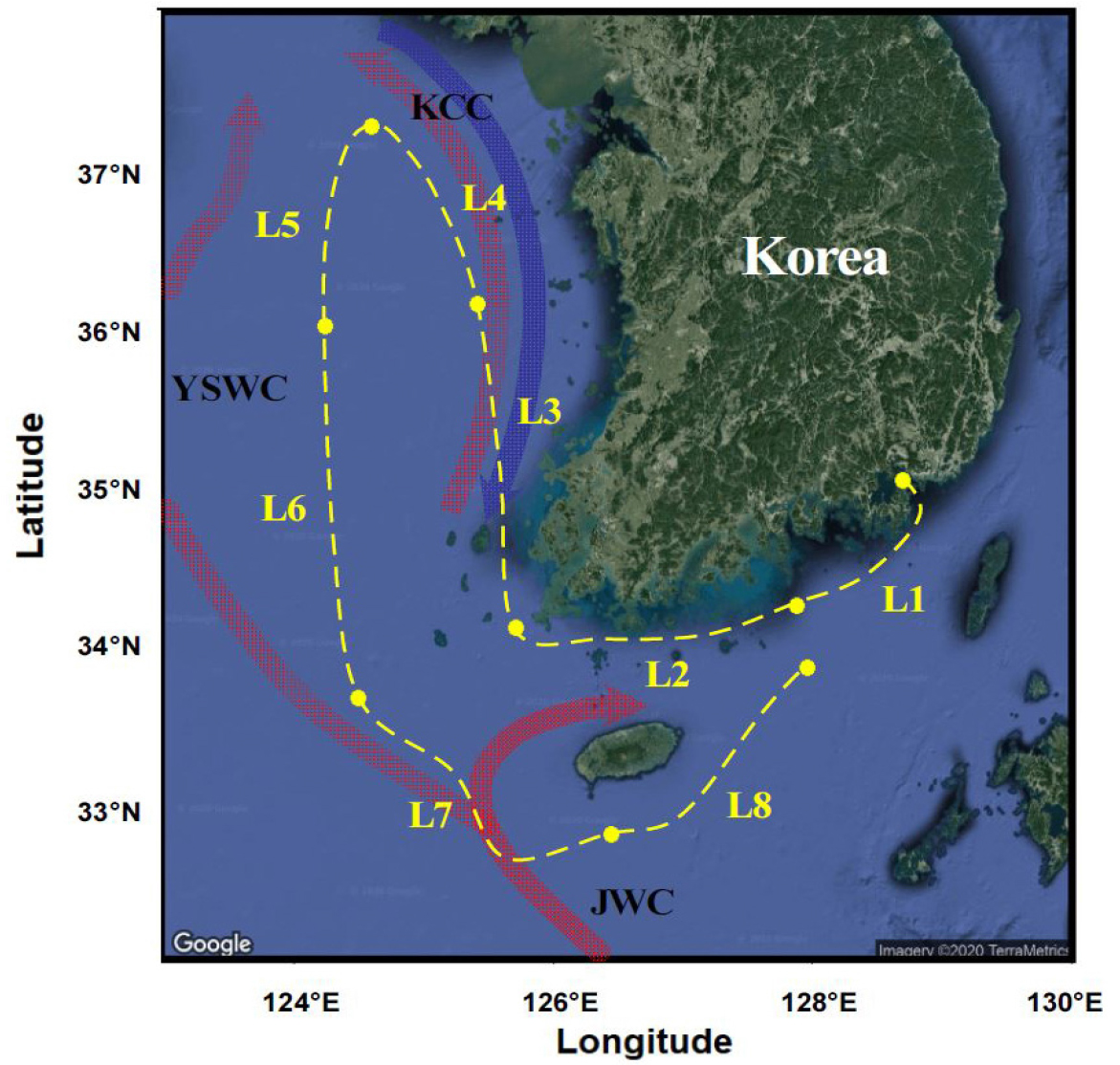
2019년 7월 2일에서 5일까지 한국해양과학기술원 온누리호 연구선(R/V Onnuri, 1,422 tons)에 고속회전식 수동형 채집 장치를 설치한 후, 남해 및 황해 연안과 외해를 조사하였다(Fig. 1). 연구선에 설치되어 있는 자동 펌프로부터 표층 아래 1 m에서의 해수를 채취하여 8.3 L/min 속도로 본체에 유입시켰으며, 실행보정물질이 흡수된 LDPE 시트 4개를 장착시킨 뒤 900 rpm으로 가동하였다. 일정 시간 노출 후, LDPE를 회수하여 초순수로 세척하고 수분을 제거한 후, 알루미늄 호일로 싸서 냉동 보관하였다. 또한 LDPE 탈부착 과정 중 오염을 보정하기 위하여 교체 시간 동안 세척된 LDPE를 현장에 노출시켜 현장바탕시료(field blank)로 사용하였다. 구체적인 조사 정보 및 고속회전식 수동형 채집 장치의 작동조건은 Table S1에 기재하였다.
고속회전식 수동형 채집 장치를 가동하는 동시에 기존의 해수 채취 방법 중 하나인 대용량 해수 채취법을 수행하였다. 각 구간별 평균적인 오염수준을 파악하기 위하여 연구선이 이동하면서 동일 해수를 주기적으로 10 L씩 10회 총 100 L를 채취하였다. 해수를 유리섬유여과지(Whatman, Maidstone, UK, 0.7 μm) 및 XAD-2 레진에 통과시켜 용존상을 포집하였다. 유리섬유여과지는 알루미늄 호일에 싸 냉동 보관하였으며 XAD-2 레진은 냉장 보관하였다.
2.3 PAHs 분석
구간별 분석되어진 LDPE의 무게는 평균 2.7 ± 0.49 g으로 2 반복 분석하였다. LDPE는 디클로로메탄 100 mL로 15분간 3번씩 초음파 추출하였다(Fernandez et al., 2012; Lao et al., 2019). XAD-2 레진은 메탄올과 디클로로메탄을 각각 300 mL씩 통과시킨 뒤 혼합하여 헥산으로 액-액(liquid-liquid) 추출하였으며, 유리섬유여과지는 잘게 자른 후 디클로로메탄으로 속실렛(Soxhlet) 추출하였다. 각 추출액은 알루미나(1% 수분함량)/실리카겔(5% 수분함량) 컬럼으로 정제한 뒤 회전식증발농축기(rotary evaporator)로 농축 및 용매 치환하여 기기분석 하였다. 분석된 모든 시료는 추출 및 기기분석 전에 내부표준물질(LDPE: fluorene-d10, fluoranthene-d10, benzo[e]pyrene-d12; XAD-2 레진: naphthalene-d8, acenaphthene-d10, phenanthrene-d10, chrysene-d12, perylene-d12)과 기체크로마토그래프 내부표준물질(terphenyl-d14)을 각각 300 ng씩 첨가하였다.
PAHs 분석은 기체크로마토그래피-질량분석법(gas chromatography-mass spectrometry) (Agilent7890GC/5975MS)을 이용하여 정량·정성 분석하였다. 모세관 컬럼은 DB-5MS (30 m × 0.25 mm i.d., 0.25 μm thickness, J&W Scientific)이며, 컬럼 승온 조건은 60°C에서 2분간 머무른 뒤 300°C까지 분당 6°C씩 증가시킨 후 13분간 유지하였다. 분석대상물질은 16종 PAHs (naphthalene; NAP, acenaphthylene; ACY, acenaphthene; ACE, fluorene; FLR, phenanthrene; PHE, anthracene; ANT, fluoranthene; FLT, pyrene; PYR, benz[a]anthracene; BaA, chrysene; CHR, benzo[b]fluoranthene; BbF, benzo[k]fluoranthene; BkF, benzo[a]pyrene; BaP, indeno[1,2,3-cd]pyrene; IcdP, dibenz[a,h]anthracene; DahA, benzo[ghi]perylene; BghiP)이다.
2.4 자유용존상 농도 산출 및 평형도달시간 예측
해수 내 PAHs의 자유용존상 농도(Cfree, ng/L)는 평형에 도달하였을 때 LDPE에서의 PAH 농도와 LDPE-water 분배계수(KPW, L/kg)로부터 구할 수 있다. 그러나 실행보정물질을 이용하게 될 경우, 평형에 도달하지 않더라도 노출 시간(t, day), LDPE에서의 PAH 농도(CtLDPE, ng/kg), LDPE의 무게(mp, kg), sampling rate (RS,target, L/day)을 이용하여 구할 수 있다(식 (1)). 본 연구에서의 노출 시간은 고속회전식 수동형 채집 장치의 가동시간을 의미한다. RS,target은 LDPE가 물로부터 분석대상물질(target compound)을 흡수하는 속도를 뜻하며 비선형 최소자승법(nonlinear least squares fit) 모델로부터 구할 수 있다(Joyce an Burgess, 2018). 분석대상물질인 16종 PAHs의 RS,target은 노출 전 LDPE에서의 실행보정물질 초기 농도(C0PRC, ng/kg)와 노출 후 LDPE에서의 농도(CtPRC, ng/kg)를 이용하여 실행보정물질의 sampling rate (RS,PRC)를 구한 뒤(식 (2)), LeBas molar volumes (Vm)을 이용하여 분석대상물질인 16종 PAHs의 RS를 예측하였다(Booij and Smedes, 2010; Apell and Gschwend, 2014; Joyce and Burgess, 2018)(식 (3)). 각 PAHs 화합물들에 대한 실행보정물질의 선정 기준은 실행보정물질 분자량의 ±10% 이내에 할당되도록 하였다.
한편 평형의 50%에 도달하는데 걸리는 시간(t1/2, days)은 식 (4)로부터 구할 수 있으며, t1/2값에 4를 곱한 시간(95% 평형도달시간)(Huckins et al., 2006)을 평형도달시간으로 간주하였다.
PAHs의 LDPE-water 분배계수(KPW)는 Lohmann(2012) 값을 이용하였으며, 수온 및 염분 보정 식(식 (5)~(6))로부터 조사기간 동안의 수온과 염분에 대해 KPW를 보정하여 사용하였다(Table S2).
KPW(T) 및 KPW(298)는 온도 T(K)와 298(K)에서의 KPW이며, [salt]는 염분 농도(M)를 뜻한다. △HPW는 LDPE와 물간의 엔탈피(kJ/mol)로 모든 화합물에 대해 –25 kJ/mol, R은 기체 상수로 8.3143 J/mol/K (Lohmann, 2012), KS는 염석 상수(salting out constant)로 0.35 M-1 값을 사용하였다(Lohmann, 2012; USEPA, 2017).
2.5 QA/QC
모든 LDPE 시료의 분석 시 내부표준물질 회수율은 85 ~ 101%이었다. 현장바탕시료에서 검출된 PAHs는 각 구간별 시료에서의 개별 PAH 농도 값에서 보정하였다. LDPE의 방법검출한계(method detection limit)은 0.24(ACY) ~ 25(FLT) ng/g으로 물에서의 자유용존상 농도로 환산할 경우 0.00010(BghiP) ~ 5.4(NAP) ng/L 범위를 보였다. XAD-2 레진의 내부표준물질 회수율은 67 ~ 83%의 범위를 보였으며, XAD-2 레진 역시 각 구간에 사용할 레진에 헥산세정수를 통과 및 추출함으로써 레진 자체에서의 오염을 보정하였다.
3. 결 과
3.1 고속회전식 수동형 채집 장치의 평형도달시간 예측
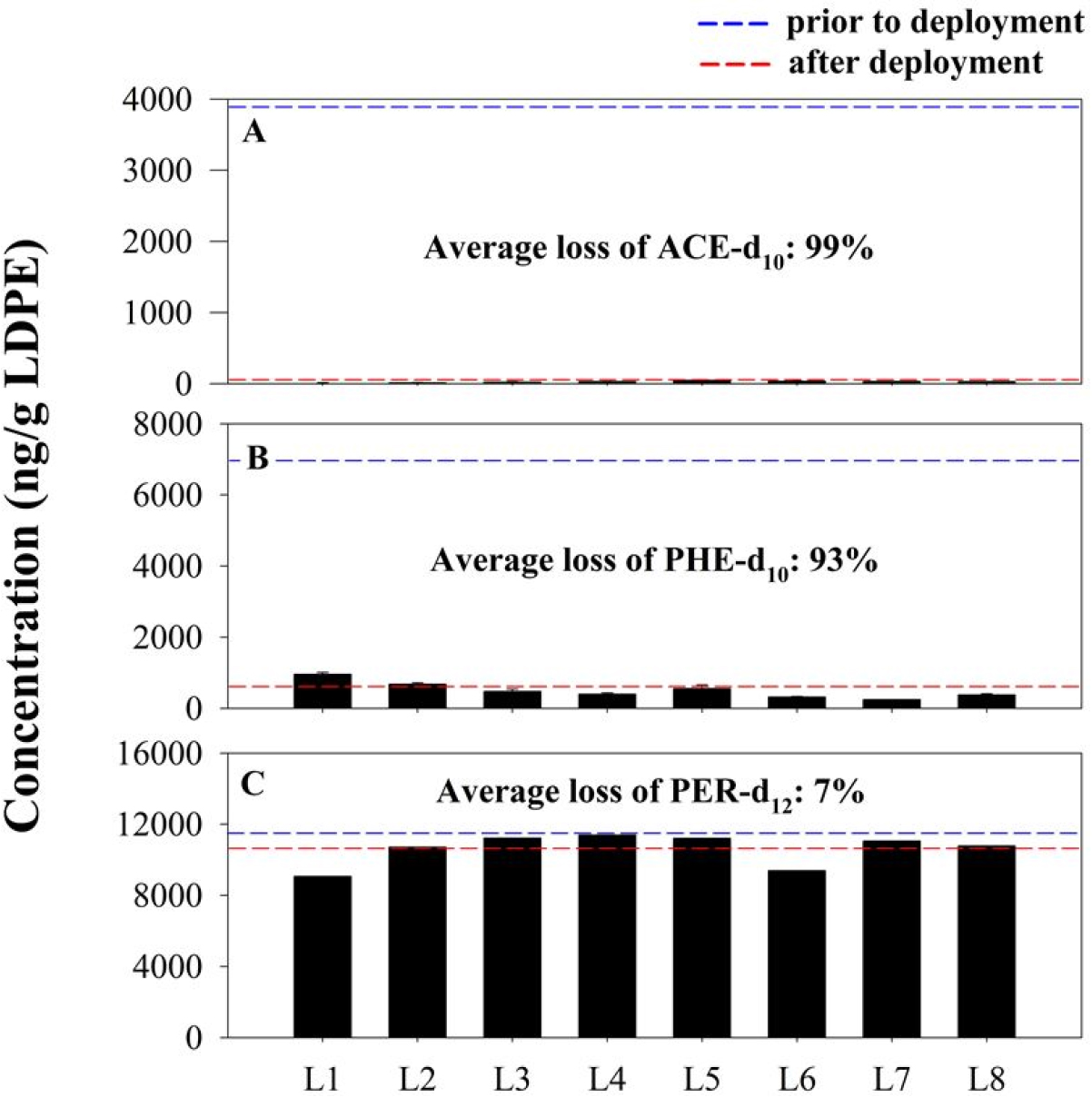
고속회전식 수동형 채집 장치로부터 16종 PAHs의 평형도달정도를 파악하기 위하여 장치 5시간 가동 전후 LDPE에서의 실행보정물질 농도를 측정하였다(Fig. S2). 분자량(molecular weight, MW)이 164 g/mol인 ACE-d10의 경우 LDPE에서의 초기 농도는 4.00×103 ± 388 ng/g이었으나, 현장 노출 후 LDPE에 남아있는 평균 농도가 26 ± 13 ng/g으로 99% 이상 감소되었다(Fig. S2A). PHE-d10 (MW=188 g/mol)은 노출 전 6.82×103 ± 634 ng/g에서 501 ± 225 ng/g으로 평균 93%가 손실되었다(Fig. S2B). 반면 PER-d12 (MW=264 g/mol)의 경우 11.4×103 ± 924 ng/g에서 10.6×103 ± 882 ng/g으로 평균 7%만이 손실되었다(Fig. S2C). 실행보정물질의 감소율은 분자량이 클수록 줄어들었는데, 이러한 현상은 고분자일수록 수동형 채집기에서 물경계층으로의 확산이 느려져 제거되는 데 오랜 시간이 걸리기 때문이다(Adams et al., 2007; Lohmann and Muir, 2010; Apell and Gschwend, 2014; Apell et al., 2016).
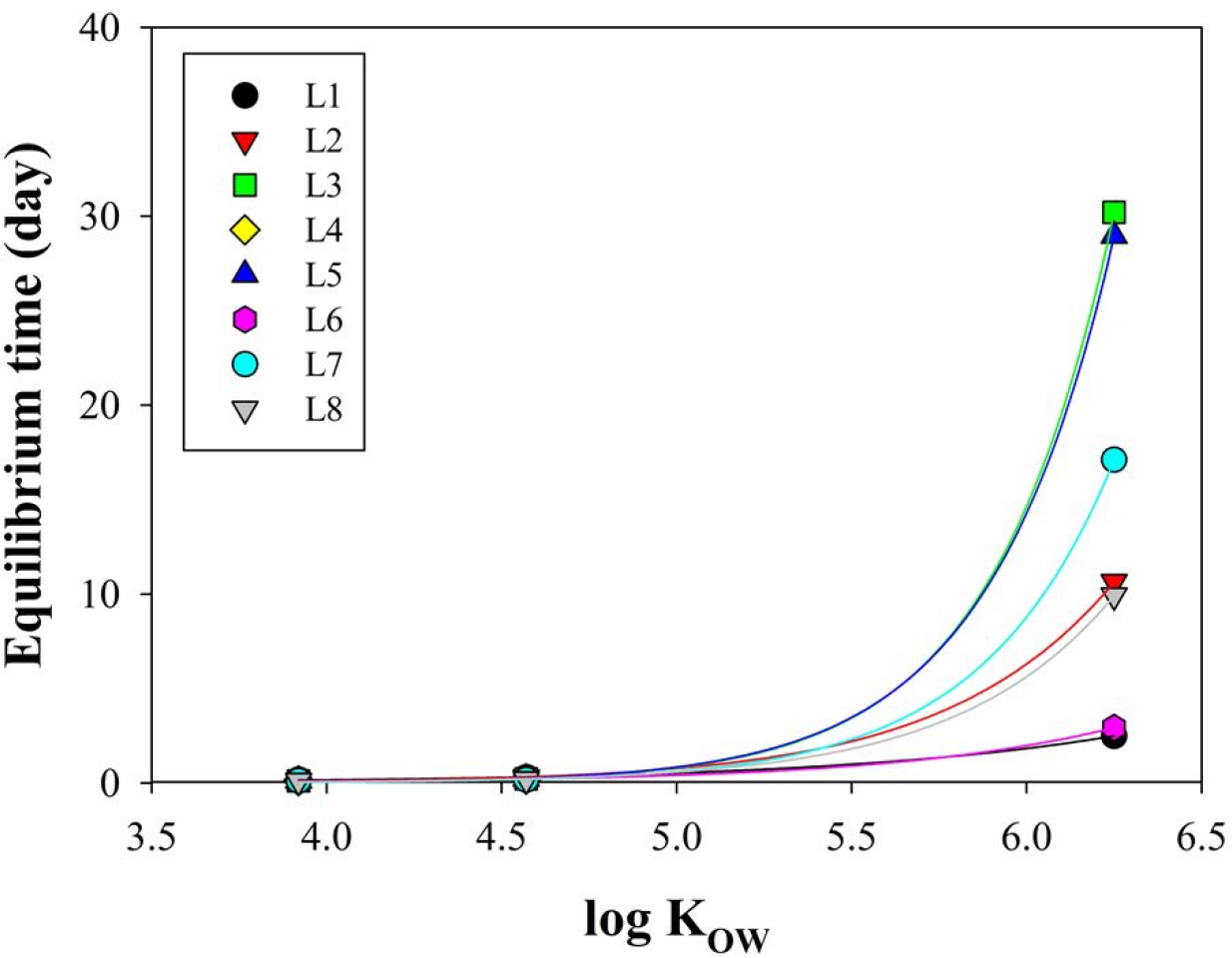
ACE-d10과 PHE-d10 분자량의 ±10%에 해당되는 PAHs는 소수성이 낮은 저분자 PAHs (NAP, ACY, ACE, FLR, PHE, ANT, FLT, PYR; log KOW 3.4 ~ 5.2)으로, 고속회전식 수동형 채집 장치를 5시간 가동하였을 때 8종 저분자 PAHs는 충분히 평형에 도달한 것으로 예측된다(Fig. 2). Allan et al.(2011)의 연구에 따르면. 반투과성막 장치(semipermeable membrane device)를 연구선 후미에 장착 후 2.2 ~ 2.8 km/h 속도로 5시간 동안 예인하였을 때, PHE-d10의 경우 오직 20%만 제거되었다. 또한 Gao et al.(2019)는 TECAM (triolein-embeded cellulose acetate membrane) 표면에 2.4 L/min 속도로 물을 24시간 동안 계속 흘려보내주었을 때, PYR-d10은 초기 농도의 20 ~ 30%가 제거될 것으로 추측하였다. 따라서 본 연구실에서 제작한 고속회전식 수동형 채집 장치는 다른 수동형 채집기에 비해 평형도달시간을 상당히 단축시켰다.
한편 PER-d12을 기준으로 보정 가능한 PAHs는 소수성이 높은 고분자 PAHs (BaA, CHR, BbF, BkF, BaP, IcdP, DahA, BghiP; log KOW 5.6 ~ 6.8)로, 식 (4)를 이용하여 구한 8종의 고분자 PAHs의 평형도달시간은 최소 2일에서 30일로 나타났다(Fig. 2). 고속회전식 수동형 채집 장치의 가동시간이 5시간으로 모두 동일함에도 불구하고 구간별 평형도달시간이 다른 이유는 구간별 이동거리의 차이에 따라 이동시간-해수에서의 총 노출 시간이 6시간에서 11시간으로 달랐기 때문으로 판단된다. 고분자 8종 PAHs 화합물의 자유용존상 농도는 각 구간별 PER-d12의 Rs를 이용하여 8종 PAHs의 Rs를 구한 뒤(식 (3)), 식 (1)과 (2)를 이용하여 구하였다. 구간 4의 경우, LDPE의 노출 전 후 실행보정물질인 PER-d12의 농도 차이가 거의 나타나지 않아 이를 이용한 농도계산은 불가능하였다.
3.2 존재 형태별 PAHs 농도 분포
3.2.1 자유용존상
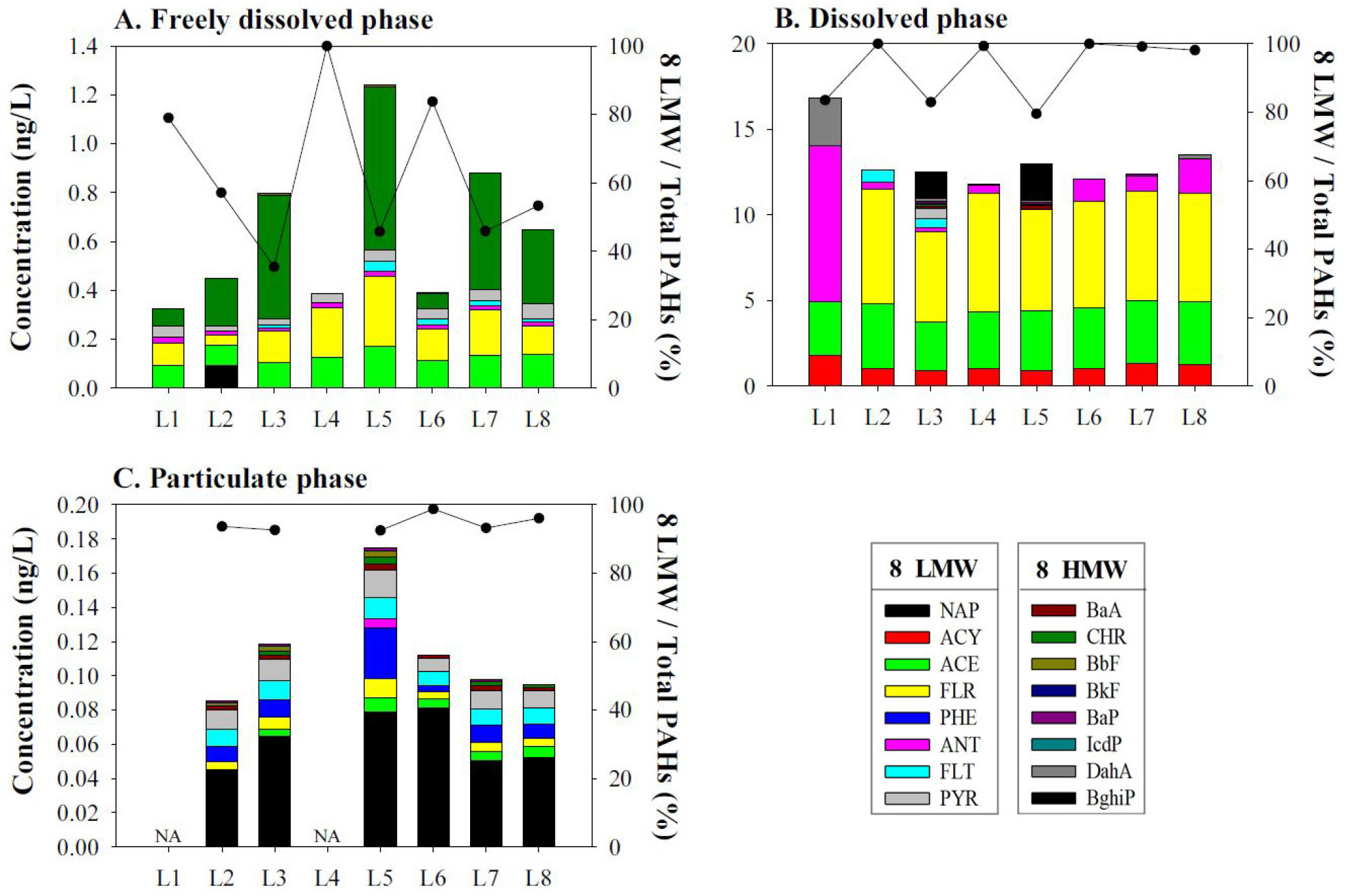
구간별 해수에서의 자유용존상 PAHs는 고속회전식 수동형 채집 장치를 이용하여 측정하였다(Table S3). 그 결과 16종 PAHs 화합물 중에서 ACE, FLR, CHR 등 벤젠고리 3 ~ 4개를 가진 저분자 화합물이 비교적 높은 비중을 차지하였으며, 벤젠고리 5개 이상인 고분자 화합물은 모든 구간에서 검출되지 않았다(Fig. 3A). PAHs는 일반적으로 분자량이 낮을수록 친수성이 커지므로, 해수에서 저분자 PAHs 비율이 상대적으로 높아지는 경향과 일치하는 것을 보여준다. 검출된 자유용존상 총 PAHs 농도는 0.32(구간 1) ~ 1.2(구간 5) ng/L의 범위로 조사 구간별 농도는 크게 차이나지 않았으나(Fig. 3A), 2020년 동일한 해역에서 선형 저밀도 폴리에틸렌(linear low density polyethylene)으로 측정된 자유용존상 PAHs 분포 특성과 유사하게 나타났다(Kim et al., 2020).
다양한 해역에서 검출된 자유용존상 PAHs 농도 범위를 Table 1에 나타내었다. 열대 대서양 및 북대서양에서의 자유용존상 PAHs 농도는 각각 0.029 ~ 0.25 ng/L와 0.010 ~ 0.25 ng/L로 검출되었다(Sun et al., 2016). 또한 북대서양 중에서도 이르밍거 해(Irminger Sea)에서의 농도는 0.049 ~ 0.20 ng/L, 카나리 유역(Canary Basin)의 경우 0.013 ~ 0.29 ng/L 범위를 보였으며, 모잠비크 해협(Mozambique Channel)에서는 0.00040 ~ 0.019 ng/L으로 매우 낮은 농도 분포를 보였다(Booij et al., 2014). 반면 해안(Grand Isle 3.8 ~ 170 ng/L; Gulfport 7.3 ~ 21 ng/L; Gulf shores 9.1 ~ 26 ng/L; Gulf Breeze 3.9 ~ 16 ng/L)(Allan et al., 2012)에서나, 항구(3.9 ~ 170 ng/L) (Monteyne et al., 2013), 하구(3.6 ~ 340 ng/L) (Zhao et al., 2018)에서는 높은 농도 범위를 보였다. 본 조사해역에서의 자유용존상 PAHs 오염 수준은 대양에서의 농도보다는 비교적 높았으나, 외국 연안에 비해서는 매우 낮은 수준이었다.
Table 1.
Freely dissolved PAH levels in various regions
| Regions | Type | Concentration (mean) (ng/L) | Sampling year | Reference |
| Irminger Sea | Ocean | 0.049 ~ 0.20 (0.11) | 2003 ~ 2005 | Booij et al.(2014) |
| Canary Basin | 0.013 ~ 0.29 (0.078) | |||
| Mozambique Channel | 0.00040 ~ 0.019 (0.0067) | |||
| Tropical Atlantic | 0.029 ~ 0.25 (0.12) | 2012 ~ 2013 | Sun et al.(2016) | |
| North Atlantic | 0.010 ~ 0.25 (0.080) | |||
| Grand Isle, USA | Coastal water | 3.8 ~ 170 | 2010 ~ 2011 | Allan et al.(2012) |
| Gulfport, USA | 7.3 ~ 21 | |||
| Gulf Shores, USA | 9.1 ~ 26 | |||
| Gulf Breeze, USA | 3.9 ~ 16 | |||
| Coastal harbours, Belgium | Harbour | 3.9 ~ 170 (27) | 2007 ~ 2010 | Monteyne et al.(2013) |
| Narragansett Bay, USA | Estuary | 3.6 ~ 340 (44) | 2014 | Zhao et al.(2018) |
| Yellow Sea/South Sea, Korea | Offshore water | 0.32 ~ 1.2 (0.64) | 2019 | This study |
3.2.2 용존상 및 입자상
구간별 해수에서의 용존상 및 입자상 PAHs는 대용량 해수 채취법을 이용하여 측정하였다(Table S3). 자유용존상과 마찬가지로 용존상에서도 벤젠 고리가 3개인 저분자 PAHs (ACY, ACE, FLR, ANT)가 80% 이상 검출되었으며, 고분자 화합물은 대부분 미검출되었다(Fig. 3B). 입자상 PAHs는 (자유)용존상과 달리 NAP이 전체 PAHs의 절반 이상 높은 비율로 검출되었으며, 나머지 화합물로는 PHE, FLT, PYR 등 벤젠고리가 3~4개인 저분자 PAHs 화합물이 주로 검출되었다(Fig. 3C).
정점별 검출된 용존상 PAHs의 총 농도는 12(구간 4) ~ 17(구간 1) ng/L으로 구간별 농도차가 통계적으로 유의미하지 않지만, 자유용존상 농도 분포와 달리 연안과 가장 가까운 구간 1에서 가장 높게 나타났다(Fig. 3B). 입자상의 경우 0.085(구간 1) ~ 0.18(구간 5) ng/L로 모든 구간에서 매우 낮게 검출되었다(Fig. 3C). 본 조사해역에서 인접한 이전 연구 사례들을 살펴보았을 때, 2004년부터 2007년까지 한국 황해에서 측정된 용존상 농도(0.06 ~ 3.19 ng/L)(환경부, 2008)보다는 비교적 높았으나, 마산만(8.61 ~ 223 ng/L)(Choi et al., 2010), 인천 송도 해안(0.68 ~ 29 ng/L) (Kim and Chae, 2016)에서 검출된 PAHs의 용존상 농도보다는 매우 낮은 수준이었다. 또한 대만 해협에서의 용존상 농도는 53 ~ 72 ng/L (Ya et al., 2018), 북쪽 남중국해에서의 용존상 및 입자상 농도는 각각 0.98 ~ 13 ng/L와 0.39 ~ 2.1 ng/L (Cai et al., 2018)으로 주변 국가 해역에서의 농도와 비교하였을 때 본 연구해역에서의 용존상 PAHs 농도는 중간정도의 수준을 보였다.
3.3 황해 및 남해에서의 PAHs 생물이용가능성
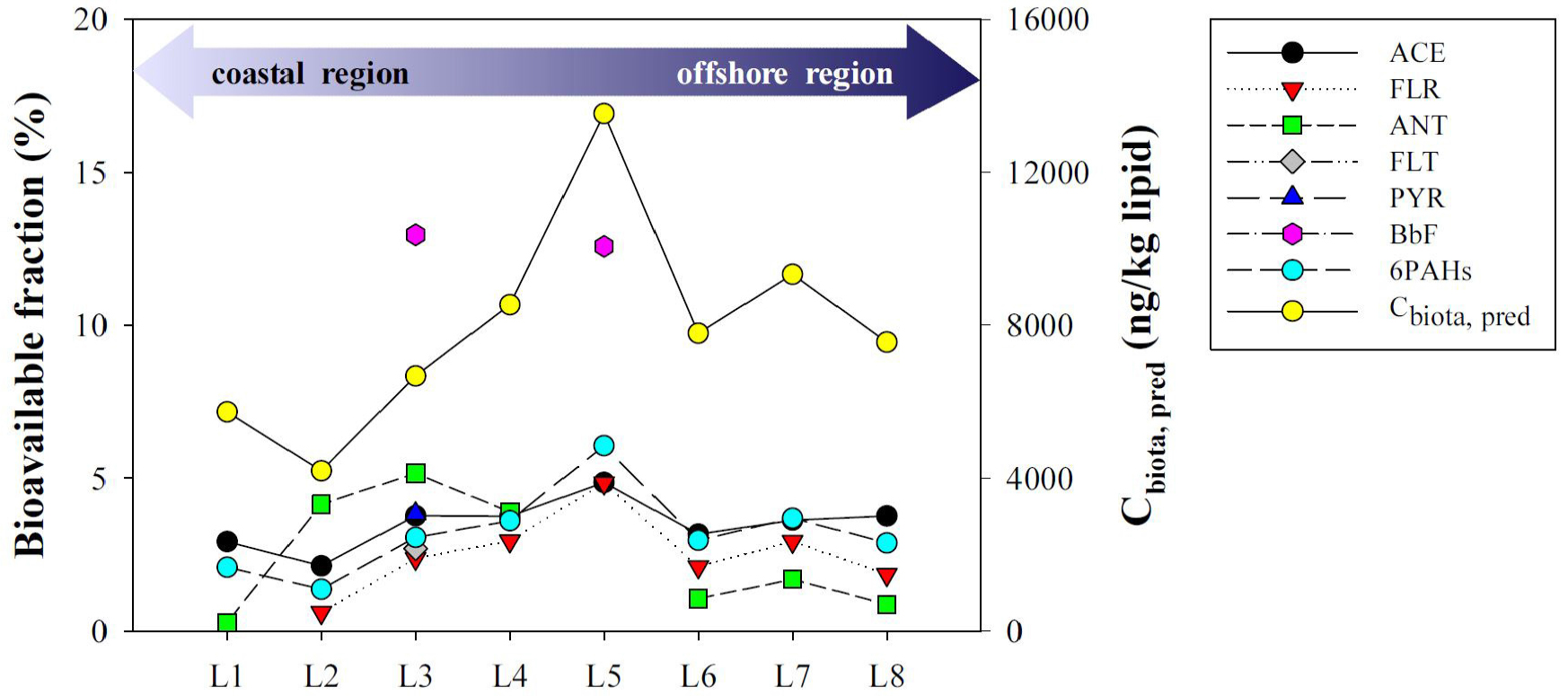
본 연구에서 자유용존상 및 용존상에서 동시에 검출된 PAHs 화합물은 총 6종(ACE, FLR, ANT, FLT, PYR, BbF)으로, 이들 화합물에 대한 용존상 내 자유용존상 비율로부터 실제 생물에 이용되어질 수 있는 비율을 계산하였다(Fig. 4). 그 결과, 각 구간별 개별 화합물의 생물이용이 가능한 비율은 용존상의 5% 내로 매우 낮았으며, 6종 화합물의 총합으로 계산하였을 때는 1.4(구간 2) ~ 6.1(구간 5)%의 범위로 구간 5에서 가장 높은 비율을 차지하였다. 용존상 중 자유용존상의 비율은 조사해역에 따라 다르게 나타났지만, 기존의 문헌값(1 ~ 10%)과는 비슷한 수준이었다(Bao et al., 2012; Jeong et al., 2020).
더불어, 자유용존상 농도(Cfree, ng/L)와 RIVM(2012)에 수록된 생물농축계수(bioconcentration factor, BCF)의 평균값을 이용하여 본 조사해역에 서식하는 어류에서의 체내 농도(Cbiota, pred, ng/kg lipid)를 예측하였다(식 (7))(Table S4).
예측되어진 어류 체내 잔류농도는 구간 5(1.4×104 ng/kg lipid)에서 가장 높았으며, 그 다음으로는 구간 7(9.3×103 ng/kg lipid), 구간 4(8.4×103 ng/kg lipid), 구간 6(7.8×103 ng/kg lipid) 순으로 나타났다(Fig. 4). 용존상 농도 분포와 달리, 자유용존상의 존재 비율과 예측된 어류 체내 잔류농도는 황해 중앙부인 구간 5에서 가장 높았으며, 연안 구간보다는 외해에서 비교적 높게 나타났다. 이러한 패턴은 일반적으로 오염수준이 높은 연안에서 외해로 갈수록 농도가 감소하리라는 예상과는 반대였으나, 황해에서의 이전 연구 결과(환경부, 2008)와는 유사하게 나타났다. 환경부(2008)는 한국과 중국의 연안에서부터 황해의 중심부까지 표층퇴적물에서의 PAHs 오염을 조사하였을 때, 각 국가의 연안에서의 농도보다 중심부로 갈수록 농도가 증가하는 경향을 보였다. 특히 폐기물이 투기되었던 서해병 배출해역은 국내 서해안보다 오염 수준이 높았다(환경부, 2008; Ohura et al., 2015). 서해병 배출해역은 군산 서방 200 km에 떨어져 있어 본 연구에서는 구간 5와 6 사이에 위치한다. 투기된 폐기물은 축산폐수 및 하수처리 오니, 축산폐수 처리 오니가 대부분으로 알려져 있는데, Park et al.(2009)와 Ju et al.(2009)에 따르면 국내 하수 및 폐수 슬러지에서의 PAHs는 ug/g 수준으로 매우 높게 검출되었다. 따라서 2016년부터 해양 투기가 전면 금지되었다하더라도, 이전에 투기되었던 폐기물에서 PAHs가 해수로 용출 및 한국연안류 또는 황해난류를 통해 주변 해역으로 확산되었을 것으로 예상된다. 또 다른 요인으로는 발해만과 중국 측 황해에서의 심각한 연안 오염에서 기인했을 가능성이 있다(Ma et al., 2001; Yoon et al., 2020). Yoon et al.(2020)에 따르면 중국대륙과 인접한 황해 및 발해만(Bohai Sea) 지역의 강, 하구 그리고 연안 퇴적물을 조사하였을 때, PAHs 화합물의 높은 농도가 조사지역의 30%에서 수생태계에 잠재적 위험요인으로 작용할 것으로 평가되었다. 따라서 연안 퇴적물에서의 심각한 오염이 해류를 통해 외해로까지 영향을 미쳤을 가능성도 있다. 그러나 정확한 오염원을 파악하기 위해서는 해수 뿐만 아니라 퇴적물과 생물 등 다매체 분석을 통한 추가적인 연구가 필요할 것으로 판단된다.
4. 결 론
본 연구에서는 LDPE가 장착된 프로토타입의 고속회전식 수동형 채집 장치를 제작하여 국내 황해와 남해에 적용하였다. 고속회전식 수동형 채집 장치의 회전속도를 900 rpm으로 가동하였을 때, 소수성이 낮은 저분자 PAHs 화합물(log KOW 3.4 ~ 5.2)은 5시간 만에 평형에 도달하였다. 반면 소수성이 높은 고분자 화합물(log KOW 5.9 ~ 6.8)은 평형에 도달하기 위하여 최소 2일에서 30일 정도 소요될 것으로 예상되었다. 그럼에도 불구하고 고속회전식 수동형 채집 장치는 5시간 만에 실행보정물질을 이용하여 모든 16종 PAHs의 자유용존상 농도를 구할 수 있었다. 그 결과 황해와 남해에서의 자유용존상 농도는 0.32 ~ 1.2 ng/L으로 다른 대양에서의 농도와 비교하였을 때 비교적 높은 수준이었지만, 외국 연안 해역에 비해서는 매우 낮은 수준이었다. 한편 검출된 자유용존상 PAHs로부터 실제 생물에게 이용되어지는 수준과 어류에서의 잔류 농도 예측 값은 용존상 농도 분포와 달리 폐기물 배출 해역이 포함된 외해에서 비교적 높은 것으로 나타났다. 따라서 화학 자료로부터 생물학적 영향을 평가하기 위해서는 생물이용가능성이 높은 자유용존상 농도를 측정하는 것이 필요로 하며, 단시간에 효과적으로 자유용존상 농도를 측정하기 위해서는 고속회전식 수동형 채집 장치의 활용이 도움 될 것으로 판단된다.
Supporting Information
Table S1.
Information of sampling
| Lines | Location |
mean water temperature1 (℃) |
mean water salinity1 (psu) |
Operating time of HSR―PSD2/ total exposure time of LDPE (h) | |
| Exposure | Retrieval | ||||
| L1 |
35°02’00.6"N 128°43’00.0"E |
34°17’00.4"N 127°58’00.7"E | 19.9 | 33.0 | 5/8 |
| L2 |
34°16’00.2"N 127°53’00.3"E |
34°05’00.6"N 125°53’00.6"E | 18.2 | 32.1 | 5/11 |
| L3 |
34°08’00.2"N 125°43’00.3"E |
36°05’00.4"N 125°26’00.4"E | 15.6 | 32.5 | 5/11 |
| L4 |
36°06’00.2"N 125°25’00.7"E |
37°06’00.9"N 124°39’00.6"E | 20.3 | 31.6 | 5/6 |
| L5 |
37°09’00.8"N 124°36’00.9"E |
36°08’00.4"N 124°14’00.7"E | 21.3 | 31.4 | 5/6 |
| L6 |
35°58’00.2"N 124°15’00.1"E |
33°47’01.0"N 124°23’00.6"E | 18.5 | 31.1 | 5/11 |
| L7 |
33°42’00.3"N 124°30’00.0"E |
32°51’00.6"N 126°27’00.5"E | 22.8 | 30.4 | 5/11 |
| L8 |
32°51’00.6"N 126°27’01.0"E |
33°53’00.3"N 127°58’00.7"E | 23.5 | 28.8 | 5/9 |
Table S2.
Physicochemical properties of 16 PAHs
| Compounds | Abbr. | Rings | MW (g/mol) |
Vm1 (cm3/mol) |
log KOW1 (L/kg) |
log KPW1 (L/kg) |
| Naphthalene | NAP | 2 | 128 | 147.6 | 3.37 | 2.9 |
| Acenaphthylene | ACY | 3 | 152 | 165.7 | 4.00 | 3.5 |
| Acenaphthene | ACE | 3 | 154 | 173.1 | 3.92 | 3.6 |
| Fluorene | FLR | 3 | 166 | 187.9 | 4.18 | 3.9 |
| Phenanthrene | PHE | 3 | 178 | 199.2 | 4.57 | 4.2 |
| Antrhracene | ANT | 3 | 178 | 196.7 | 4.54 | 4.2 |
| Fluoranthene | FLT | 4 | 202 | 217.3 | 5.22 | 4.9 |
| Pyrene | PYR | 4 | 202 | 213.8 | 5.18 | 4.9 |
| Benz[a]anthracene | BaA | 4 | 228 | 248.3 | 5.91 | 5.6 |
| Chrysene | CHR | 4 | 228 | 250.8 | 5.60 | 5.6 |
| Benzo[b]fluoranthene | BbF | 5 | 252 | 268.9 | 5.80 | 6.2 |
| Benzo[k]fluoranthene | BkF | 5 | 252 | 268.9 | 6.00 | 6.2 |
| Benz[a]pyrene | BaP | 5 | 252 | 262.9 | 6.04 | 6.2 |
| Indeno[1,2,3-cd]pyrene | IcdP | 6 | 276 | 283.5 | - | 6.9 |
| Dibenz[a,h]anthracene | DahA | 6 | 278 | 299.9 | 6.75 | 6.9 |
| Benzo[ghi]perylene | BghiP | 6 | 276 | 277.5 | 6.50 | 6.9 |
Table S3.
Freely dissolved, dissolved, and particulate concentrations (ng/L) in seawater
| 16PAHs | L1 | L2 | L3 | L4 | L5 | L6 | L7 | L8 |
| Freely dissolved concentrations (ng/L)1 | ||||||||
| NAP | <4.9 | 0.10±0.072 | <4.9 | <4.9 | <4.9 | <4.9 | <4.9 | <4.9 |
| ACY | <0.074 | <0.074 | <0.074 | <0.074 | <0.074 | <0.074 | <0.074 | <0.074 |
| ACE | 0.098 | 0.081 | 0.11 | 0.12 | 0.17 | 0.11 | 0.13 | 0.14 |
| FLR | 0.093±0.067 | 0.040±0.040 | 0.13±0.00072 | 0.21±0.031 | 0.29±0.023 | 0.13±0.035 | 0.19±0.091 | 0.12±0.016 |
| PHE | <0.90 | <0.90 | <0.90 | <0.90 | <0.90 | <0.90 | <0.90 | <0.90 |
| ANT | 0.025 | 0.017 | 0.015 | 0.018 | 0.023 | 0.014 | 0.015 | 0.018 |
| FLT | <0.34 | <0.34 | 0.014±0.006 | 0.0042±0.00 | 0.038±0.007 | 0.027±0.000 | 0.023±0.000 | 0.012±0.004 |
| PYR | 0.045±0.012 | 0.020±0.009 | 0.023±0.011 | 0.035±0.011 | 0.049±0.008 | 0.043±0.010 | 0.045±0.015 | 0.062±0.024 |
| BaA | <0.0023 | <0.0023 | <0.0023 | <0.0023 | <0.0023 | <0.0023 | <0.0023 | <0.0023 |
| CHR | 0.068±0.028 | 0.19±0.058 | 0.51±0.094 | NA | 0.66±0.064 | 0.062±0.007 | 0.48±0.11 | 0.30±0.099 |
| BbF | <0.00034 | <0.00034 | <0.00034 | <0.00034 | <0.00034 | <0.00034 | <0.00034 | <0.00034 |
| BkF | <0.00040 | <0.00040 | <0.00040 | <0.00040 | <0.00040 | <0.00040 | <0.00040 | <0.00040 |
| BaP | <0.00026 | <0.00026 | <0.00026 | <0.00026 | <0.00026 | <0.00026 | <0.00026 | <0.00026 |
| IcdP | <0.00021 | <0.00021 | <0.00021 | <0.00021 | <0.00021 | <0.00021 | <0.00021 | <0.00021 |
| DahA | <0.00011 | <0.00011 | <0.00011 | <0.00011 | <0.00011 | <0.00011 | <0.00011 | <0.00011 |
| BghiP | <0.00010 | <0.00010 | <0.00010 | <0.00010 | <0.00010 | <0.00010 | <0.00010 | <0.00010 |
| Total | 0.32 | 0.45 | 0.80 | 0.39 | 1.2 | 0.39 | 0.88 | 0.65 |
| 16PAHs | Dissolved concentrations (ng/L) | |||||||
| NAP | ND | ND | ND | ND | ND | ND | ND | ND |
| ACY | 1.8 | 1.0 | 0.9 | 1.0 | 0.9 | 1.0 | 1.3 | 1.3 |
| ACE | 3.1 | 3.8 | 2.8 | 3.3 | 3.5 | 3.5 | 3.7 | 3.6 |
| FLR | ND | 6.7 | 5.3 | 7.0 | 5.9 | 6.2 | 6.4 | 6.4 |
| PHE | ND | ND | ND | ND | ND | ND | ND | ND |
| ANT | 9.1 | 0.40 | 0.29 | 0.46 | ND | 1.3 | 0.87 | 2.0 |
| FLT | ND | 0.72 | 0.52 | ND | ND | ND | ND | ND |
| PYR | ND | ND | 0.59 | ND | ND | ND | ND | ND |
| BaA | ND | ND | 0.11 | ND | 0.22 | ND | ND | ND |
| CHR | ND | ND | 0.084 | ND | ND | ND | ND | ND |
| BbF | ND | ND | 0.078 | ND | 0.065 | ND | ND | ND |
| BkF | ND | ND | ND | ND | ND | ND | ND | ND |
| BaP | ND | ND | 0.14 | 0.08 | 0.095 | ND | 0.10 | ND |
| IcdP | ND | ND | ND | ND | ND | ND | ND | ND |
| DahA | 2.78 | ND | 0.16 | ND | 0.16 | ND | ND | 0.25 |
| BghiP | ND | ND | 1.6 | ND | 2.1 | ND | ND | ND |
| Total | 17 | 13 | 13 | 12 | 13 | 12 | 12 | 14 |
| 16PAHs | Particulate concentrations (ng/L) | |||||||
| NAP | NA | 0.045 | 0.065 | NA | 0.079 | 0.081 | 0.050 | 0.053 |
| ACY | ND | ND | ND | ND | ND | ND | ||
| ACE | ND | 0.0045 | 0.0084 | 0.0054 | 0.0054 | 0.0060 | ||
| FLR | 0.0049 | 0.0067 | 0.012 | 0.0043 | 0.0056 | 0.0047 | ||
| PHE | 0.0087 | 0.010 | 0.029 | 0.0035 | 0.010 | 0.0087 | ||
| ANT | ND | ND | 0.0051 | ND | ND | ND | ||
| FLT | 0.010 | 0.011 | 0.013 | 0.0080 | 0.010 | 0.0091 | ||
| PYR | 0.011 | 0.012 | 0.016 | 0.0079 | 0.011 | 0.010 | ||
| BaA | 0.0023 | 0.0025 | 0.0036 | 0.0015 | 0.0030 | 0.0020 | ||
| CHR | ND | 0.0026 | 0.0038 | ND | 0.0025 | 0.0018 | ||
| BbF | 0.0020 | 0.0024 | 0.0040 | ND | ND | ND | ||
| BkF | ND | ND | ND | ND | ND | ND | ||
| BaP | 0.0012 | 0.0013 | 0.0019 | ND | 0.0012 | ND | ||
| IcdP | ND | ND | ND | ND | ND | ND | ||
| DahA | ND | ND | ND | ND | ND | ND | ||
| BghiP | ND | ND | ND | ND | ND | ND | ||
| Total | 0.085 | 0.12 | 0.18 | 0.11 | 0.10 | 0.095 | ||
Table S4.
Predicted residual PAH concentrations in biota (fish)
| PAHs | Average BCF values for fish1 | Predicted PAH concentrations in biota (ng/kg lipid) | |||||||
| L1 | L2 | L3 | L4 | L5 | L6 | L7 | L8 | ||
| NAP | 292 | ND | 574 | ND | ND | ND | ND | ND | ND |
| ACE | 981 | 1,804 | 1,596 | 2,084 | 2,432 | 3,356 | 2,200 | 2,597 | 2,691 |
| FLR | 1,097 | 2,052 | 889 | 2,745 | 4,510 | 6,273 | 2,865 | 4,132 | 2,576 |
| ANT | 2,777 | 1,394 | 919 | 819 | 992 | 1279 | 764 | 821 | 976 |
| FLT | 2,771 | ND | ND | 782 | 233 | 2098 | 1502 | 1298 | 653 |
| PYR | 533 | 484 | 217 | 241 | 370 | 526 | 460 | 484 | 662 |
| Total | 5,733 | 4,194 | 6,672 | 8,537 | 13,532 | 7,791 | 9,333 | 7,559 | |
1Calculated from RIVM(2012). The values were normalized to 5% lipid content.



 ).
).