1. 서 론
2. 재료 및 방법
2.1 시료 채취 및 전처리
2.2 무기화학조성 및 동위원소 분석
2.3 통계 분석
3. 결과 및 토의
3.1 무기화학조성 특성
3.2 스트론튬 동위원소 특성
4. 결 론
1. 서 론
감태(Ecklonia cava; E. cava)는 갈조식물 다시마목 미역과에 속하는 해조류로 부착기, 줄기, 엽상부로 나뉜다. 부착기는 육상식물의 뿌리 모양을 하며, 줄기는 원주상, 엽상부는 하나의 타원형에서 여러 개로 분지된 작은 가지 모양이다. 감태는 대한민국과 일본의 해안에서만 널리 분포하며, 대한민국에서는 동해 해역 수심 5~10 m 부근에서 1~2 m 내외의 크기로 대군락을 형성하여 다양한 해양 생물의 생육지로써 중요한 역할을 한다(Choi et al., 2007; Kang and Kim, 2009; Cho and Choi, 2010).
지금까지 감태에 대한 연구는 주로 생태학 및 기능학적 관점에 초점을 맞추어 진행되었다(Athukorala et al., 2006; Hong et al., 2006; Li et al., 2009). 예를 들어, 최근 기후 변화로 인한 수온 상승 및 해양 오염으로 인해 감태의 개체수가 급격히 감소하고 있음이 보고되었다(Serisawa et al., 2004; Kim et al., 2013). 또한 감태는 후코이단과 폴리페놀인 플로로탄닌 등을 함유하고 있어 대식세포에서 일산화질소(NO)의 생성을 억제하는 항염증 효과가 나타났으며(Lee et al., 2012), 멜라닌 생성과 UV-B 방사선 유발 세포 손상을 억제하는 효과를 나타낸다고 보고되었다(Heo et al., 2009). 이러한 특징 때문에 감태는 식품, 의약품, 화장품 등 다양한 분야의 원료로 널리 사용되고 있다(Wijesinghe and Jeon, 2012; Hwang et al., 2013).
감태의 다양한 분야에서 수요 증가 및 갯녹음 현상으로 인한 자연 군집의 급속한 감소(Choi, 2007)를 해결하기 위해 체계적인 자연 생태계의 복원과 균형 유지를 위한 측면에서 인공어초를 활용한 바다숲 조성 기술이 개발되어 활용되고 있다(Oh et al., 2010). 현재까지 이루어진 대부분의 연구는 주로 인공 어초 시설로 인한 개체의 수, 다양성 증가 등의 효과 및 형태 비교에 대한 연구이며(Ahn and Kim, 2000; Kim et al., 2011; Kim et al., 2012; Hwang, 2017; Kim et al., 2019), 자연 생육 감태와의 무기화학적 특성 비교에 관한 연구를 통한 인공 이식된 감태 개체군의 자연 환경에서의 적응력을 평가하고 감태 수요 증가에 따른 자연 생육 감태와의 명확한 구분 및 기원판별을 위한 연구는 아직까지 전무한 실정이다.
스트론튬 동위원소 비(87Sr/86Sr)는 1) 지표온도에서의 반응이나 생물학적 과정에 의해 분별되지 않고, 2) 각종 지질매체 내에서의 87Sr/86Sr 비는 초기 87Sr/86Sr 비, 암석이나 광물의 생성 시기 및 초기 Rb/Sr 비에 의해 영향을 받고, 3) 식생의 87Sr/86Sr 비는 성장 당시 흡수된 Sr의 기원을 그대로 반영하게 된다. 이러한 이유로 많은 연구에서 87Sr/86Sr 비는 다양한 식생의 지리학적 기원을 밝히는 중요한 도구로 널리 활용되고 있다(Faure, 1986; Stewart et al., 1998; Song et al., 2014).
따라서 이번 연구에서는 포항시 구룡포 해역 암반에서 채취한 자연 생육 감태와 인위적으로 이식된 감태의 무기화학조성 및 87Sr/86Sr 비 분석을 통해 두 개체군간, 각 부위별 화학적 특성을 비교 분석하고, 이를 활용한 자연 생육과 인공 이식된 감태의 구분 가능성을 살펴보고자 하였다.
2. 재료 및 방법
2.1 시료 채취 및 전처리
동해 남부에 위치한 포항시 구룡포 해역은 쿠로시오 해류의 지류인 쓰시마 난류의 영향을 받으며 비교적 수심이 깊고 해류 흐름이 원활하나 태풍이나 냉수대와 같은 환경 요소에 의해 해양 환경의 변화가 매우 복잡한 특성을 보인다(Park and Choi, 2009; Lee et al., 2016). 포항시에서 해조류 144종이 출현하여 해역별로 차이를 보이며 감태 등의 대형갈조류가 번무하는 것으로 보고되었다(Nam et al., 1996). 2022년 12월 경상북도 포항시 구룡포읍 삼정리 해역 5 m 수심의 자연 암반 및 2016년에 시설된 인공 어초에서 동일 크기의 각각 5개체씩 총10개체의 감태(EC1-EC10)를 채취하였다.
채취된 감태 시료는 염분과 불순물 제거를 위해 3차 증류수로 3번 이상 세척한 후, 뿌리, 줄기, 잎 부위를 잘라 자연 건조 시켰다. 이후 건조된 시료를 자동분쇄기(Retsch, MM200)를 이용하여 분쇄한 후 균질화하였다. 분쇄된 시료 약 0.5 g을 60 mL 테플론 용기에 넣고 고농도 정제 질산(HNO3) 6 mL와 고농도 과산화수소(H2O2) 1 mL를 넣은 후 48시간 동안 상온에서 반응시킨 후, 고농도 정제 염산(HCl) 3 mL를 넣고 가열판에서 180°C로 24시간 가열하였다. 이후 용액을 증발건조시킨 후 2% HNO3 10 mL로 희석하여 무기화학조성 및 동위원소 분석을 수행하였다.
2.2 무기화학조성 및 동위원소 분석
무기화학조성(Na, K, Ca, Mg, and Sr) 분석은 국립부경대학교 지구환경 융합분석센터에 설치된 유도결합 플라즈마 분광분석기(Inductively Coupled Plasma Optical Emission Spectroscopy; ICP-OES, Optima 7000DV, Perkin Elmer, USA)을 이용하였다. 분석 정확도 및 정밀도는 3종의 분석인증물질인 TMDW (Drinking Water; High-Purity Standards, USA), SLRS-6 (River water; National Research Council Canada, Canada), IAPSO (Seawater; Ocean Scientific International Ltd, UK) 분석을 통해 확인하였다(Table 1).
Table 1.
Inorganic elemental compositions in three certified reference materials
| Element | TMDW1 | SLRS-62 | IAPSO3 | |||||||
| Certified value | Measured value | Recovery | Certified value | Measured value | Recovery | Certified value | Measured value | Recovery | ||
| (mg/L) | (%) | (mg/L) | (%) | (mg/L) | (%) | |||||
| Na | 6.00 | 5.79 | 97 | 2.77 | 2.58 | 93 | 10770 | 10545 | 98 | |
| K | 2.50 | 2.59 | 104 | 0.65 | 0.64 | 98 | 399 | 383 | 96 | |
| Ca | 35.0 | 32.8 | 94 | 8.77 | 8.58 | 98 | 412 | 369 | 90 | |
| Mg | 9.00 | 8.85 | 98 | 2.14 | 2.19 | 102 | 1290 | 1284 | 100 | |
| Sr | 0.25 | 0.25 | 100 | 0.04 | 0.04 | 100 | 7.90 | 7.69 | 97 | |
스트론튬 동위원소 비(87Sr/86Sr) 분석을 위해 먼저 Eichrom사의 Sr-resin (100-150 µm)을 사용하여 전처리된 용액 내 Sr만 분리한 후, 국립부경대학교 지구환경 융합분석센터에 설치된 다검출기 유도결합 플라즈마 질량분석기(Multi-Collector Inductively Coupled Plasma Mass Spectrometer; MC-ICP-MS, Neoma, Thermo Fisher Scientific, Germany)를 사용하여 87Sr/86Sr 비를 분석하였다. 분석된 87Sr/86Sr 비는 86Sr/88Sr = 0.1194 (Nier, 1938)을 이용하여 내부보정하였고, 동위원소 분석인증물질인 NBS 987 (National Institute of Standards and Technology, USA)의 중복 분석 결과는 87Sr/86Sr = 0.710247 ± 0.000019 (n = 10, 2SD)이었다. 또한 해수인증물질인 IAPSO의 87Sr/86Sr = 0.709176 ± 0.000021 (n = 4, 2SD)로 이전 연구와 일치하였다(Krabbenhöft et al., 2009).
2.3 통계 분석
자연 생육 감태와 인공 이식된 감태 개체군 간의 통계적 유의성을 파악하기 위해 t-test를 수행하였다. t-value는 두 집단의 평균 차이를 불확실도로 나눈 것으로, 절댓값이 클수록 두 집단 사이의 평균 차이가 크고, 값이 음수일 경우 먼저 입력한 집단의 평균이 더 낮음을 의미한다. t-test 차이의 유의 수준은 p < 0.05일 경우 통계적으로 유의한 것으로 간주되었다. 자료 분석은 Microsoft Excel 프로그램(ver. 16.82)을 이용하였다.
3. 결과 및 토의
3.1 무기화학조성 특성
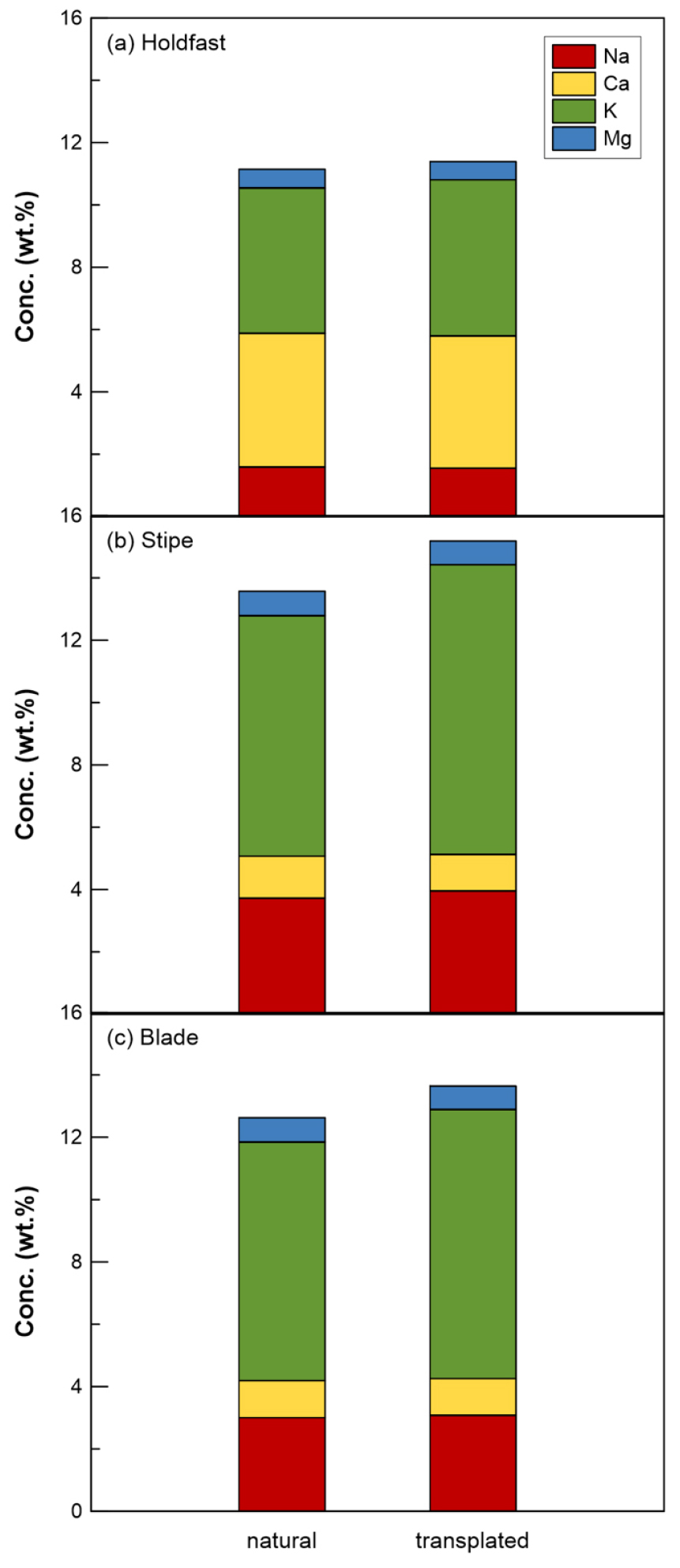
자연 생육 감태와 인공 이식된 감태의 부위별 무기화학조성은 Tables 2 and 3에 제시되었다. 총 5개 자연 생육 감태의 총 무기화학조성은 칼륨(K) (6.56 ± 1.67 wt.%, n = 15) > 나트륨(Na) (2.79 ± 0.96 wt.%, n = 15) > 칼슘(Ca) (2.18 ± 1.50 wt.%, n = 15) > 마그네슘(Mg) (0.72 ± 0.11 wt.%, n = 15) > 스트론튬(Sr) (1866 ± 960 mg/kg, n = 15)의 순으로 감소하였다. 또한 각 원소별 부위에 따른 무기화학조성 존재비는 Ca와 Sr를 제외한 모든 원소에서 줄기 > 잎 > 뿌리의 순으로 감소하였다(Fig. 1). 마찬가지로, 총 5개 인공 이식된 감태의 총 무기화학조성은 K (7.79 ± 2.30 wt.%, n = 15) > Na (2.85 ± 1.05 wt.%, n = 15) > Ca (2.22 ± 1.74 wt.%, n = 15) > Mg (0.70 ± 0.10 wt.%, n = 15) > Sr (1772 ± 832 mg/kg, n = 15)의 순으로 감소하였다. 또한 각 원소별 부위에 따른 무기화학조성 존재비 역시 자연 생육 감태와 마찬가지로 Ca와 Sr를 제외한 모든 원소에서 줄기 > 잎 > 뿌리의 순으로 감소하였다(Fig. 1).
Table 2.
Inorganic elemental compositions in natural and transplanted Ecklonia cava collected in East Sea
Table 3.
Sr concentrations and isotopic compositions in natural and transplanted Ecklonia cava collected in East Sea
| Sample | Sr | 87Sr/86Sr | 2SE1 | |
| (mg/kg) | ||||
| Natural E. cava | ||||
| EC1 | holdfast | 3244 | 0.709196 | 0.000018 |
| stipe | 1593 | 0.709192 | 0.000019 | |
| blade | 926 | 0.709197 | 0.000030 | |
| EC2 | holdfast | 3005 | 0.709165 | 0.000026 |
| stipe | 1394 | 0.709177 | 0.000018 | |
| blade | 973 | 0.709210 | 0.000017 | |
| EC3 | holdfast | 3104 | 0.709173 | 0.000020 |
| stipe | 1720 | 0.709182 | 0.000018 | |
| blade | 888 | 0.709212 | 0.000017 | |
| EC4 | holdfast | 3203 | 0.709204 | 0.000029 |
| stipe | 1403 | 0.709189 | 0.000025 | |
| blade | 875 | 0.709213 | 0.000021 | |
| EC5 | holdfast | 3054 | 0.709210 | 0.000019 |
| stipe | 1613 | 0.709178 | 0.000022 | |
| blade | 997 | 0.709207 | 0.000021 | |
| Transplanted E. cava | ||||
| EC6 | holdfast | 2758 | 0.709181 | 0.000018 |
| stipe | 1320 | 0.709171 | 0.000017 | |
| blade | 1045 | 0.709187 | 0.000018 | |
| EC7 | holdfast | 3325 | 0.709169 | 0.000021 |
| stipe | 1552 | 0.709165 | 0.000019 | |
| blade | 908 | 0.709183 | 0.000020 | |
| EC8 | holdfast | 2757 | 0.709162 | 0.000019 |
| stipe | 1379 | 0.709186 | 0.000018 | |
| blade | 1085 | 0.709177 | 0.000020 | |
| EC9 | holdfast | 2684 | 0.709178 | 0.000015 |
| stipe | 1330 | 0.709180 | 0.000020 | |
| blade | 1210 | 0.709204 | 0.000014 | |
| EC10 | holdfast | 2815 | 0.709168 | 0.000019 |
| stipe | 1461 | 0.709188 | 0.000018 | |
| blade | 956 | 0.709187 | 0.000019 | |
두 개체군간 무기화학조성 존재비(K > Na > Ca > Mg)는 해수의 무기화학조성 존재비(Na > Mg > Ca > K; Millero, 1974)와 다른 특성을 보이고 있다(Fig. 1). 이는 감태 내 필요한 무기화학성분이 줄기와 잎의 세포공을 통해 해수에서 직접 흡수되었거나, 뿌리와 암반의 물리화학적 상호작용으로 인해 암석 내 원소가 흡수된 결과로 판단된다(Morrison et al., 2009; Lee et al., 2011). 그러나 Na의 농도가 뿌리보다는 줄기와 잎에서 약 2배 높은 것은 감태 내 무기화학성분이 해수로부터 줄기와 잎의 세포공을 통해 흡수되었다는 사실을 반영하는 것으로 판단된다(Lee et al., 2011). 또한 줄기와 잎 부위의 K농도는 뿌리에서의 농도보다 약 2배 높은 값을 보이는데 이는 감태 생장 시 뿌리는 암석 내 부착을 위한 역할을 담당하고, 줄기와 잎만 생장하며 이때 K가 중요한 필수 원소임을 시사한다(Lee et al., 2011).
알칼리 금속인 K와 달리 알칼리 토금속인 Ca와 Sr의 농도는 뿌리, 줄기, 잎의 순서로 감소하는 특성이 있는데 이는 두 원소가 감태 생장에서 역할이 다른 원소에 비해 크지 않음을 지시하며, 이들 원소는 뿌리가 부착된 암석으로부터의 영향을 반영한 것으로 판단된다(이에 대한 추가적인 고찰은 다음 절에서 논의).
두 개체군간 총 무기화학조성에 대한 t-test 분석결과, K (t = -1.67, p > 0.05), Na (t = -0.16, p > 0.05), Ca (t = -0.07, p > 0.05), Mg (t = 0.51, p > 0.05), Sr (t = 0.29, p > 0.05)로 모두 통계적으로 유의한 차이가 존재하지 않았다. 따라서 총 무기화학조성으로는 자연 생육 감태와 인공 이식된 감태의 분류가 불가능한 것으로 판단된다.
또한 각 원소별 부위에 따른 t-test 분석결과, 1) K: 뿌리(t = -0.70, p > 0.05), 줄기(t = -2.42, p < 0.05), 잎(t = -2.42, p < 0.05), 2) Na: 뿌리(t = 0.49, p > 0.05), 줄기(t = -0.95, p > 0.05), 잎(t = -0.19, p > 0.05), 3) Ca: 뿌리(t = -0.20, p > 0.05), 줄기(t = 2.11, p > 0.05), 잎(t = -1.08, p > 0.05), 4) Mg: 뿌리(t = 0.43, p > 0.05), 줄기(t = 0.54, p > 0.05), 잎(t = 0.67, p > 0.05), 5) Sr: 뿌리(t = 2.04, p > 0.05), 줄기(t = 1.76, p > 0.05), 잎(t = -1.89, p > 0.05)로 각 원소별 부위에 따른 통계적 유의성이 존재하지 않았다. 그러나, K가 줄기와 잎 부위에서 자연 개체군이 인공 개체군에 비해 평균이 더 낮은 유의한 차이가 존재하는 것으로 나타났다. 이러한 특성은 자연 개체군에 비해 인공 개체군에서 해수로부터 K가 많이 흡수되어 생장이 활발하게 일어나는 것으로 판단된다. 이는 Jeong(2021)이 보고한 연구 지역에서 인공 개체군이 자연 개체군에 비해 높은 생물량을 나타낸 결과와 일치한다.
3.2 스트론튬 동위원소 특성
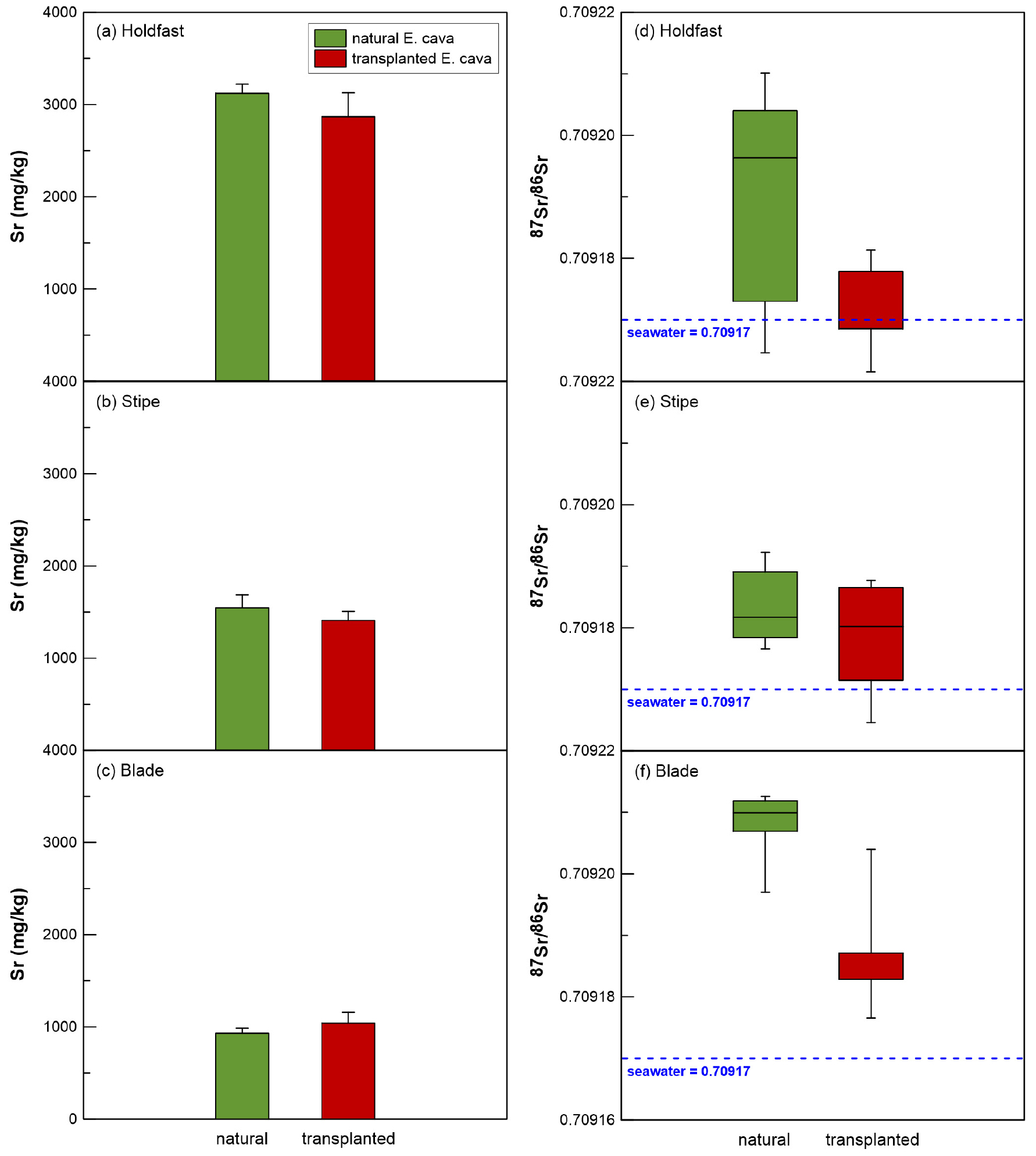
자연 생육 감태와 인공 이식된 감태의 Sr 동위원소 비(87Sr/86Sr)는 Table 3에 제시되었다. 자연 생육 감태와 인공 이식된 감태의 평균 87Sr/86Sr 비는 각각 0.709194 ± 0.000016 (n = 15)와 0.709179 ± 0.000011 (n = 15)로 두 개체군간 차이는 0.000015로 분석오차 내에서 동일하였다. 그러나 두 개체군의 벌크 87Sr/86Sr 비는 해수의 87Sr/86Sr 비인 0.70917 보다 높았다. 일반적으로 생물체 내 87Sr/86Sr 비는 분별작용 없이 기원물질의 값을 직접 반영하기 때문에 이러한 결과는 두 개체군 내 Sr은 해수와 그 외의 다른 물질에서 흡수되어 혼합되었음을 시사한다(Faure, 1986; Stewart et al., 1998). 연구지역 내 기반암과 인공어초에 대한 87Sr/86Sr 비를 분석하지 못했지만, 경상분지 내 현무암의 87Sr/86Sr 비는 0.70722 ~ 0.71145 (Kwon et al., 2013)과 시멘트의 87Sr/86Sr 비는 0.7076 ~ 0.7265 (Graham et al., 2000; Kazlagić et al., 2023)로 보고되었다. 따라서, 감태 내 Sr은 착생한 현무암이나 시멘트에서 흡수된 Sr과 해수에서 흡수된 Sr의 영향을 함께 반영하는 것으로 판단된다.
자연 생육 감태의 부위별 87Sr/86Sr 비는 잎(0.709208 ± 0.000006, n = 5) > 뿌리(0.709190 ± 0.000020, n = 5) > 줄기(0.709184 ± 0.000007, n = 5)의 순으로 감소하였고, 인공 이식된 감태의 부위별 87Sr/86Sr 비는 잎(0.709188 ± 0.000010, n = 5) > 줄기(0.709178 ± 0.000010, n = 5) > 뿌리(0.709172 ± 0.000008, n = 5)의 순으로 감소하였다(Fig. 2). 이는 뿌리에서 87Sr/86Sr 비가 높은 현무암 및 시멘트 내 Sr을 흡수한 후 줄기와 잎까지 흡수된 현무암 및 시멘트 내 Sr이 이동한 후 줄기와 잎의 세포공을 통해 흡수된 해수와 혼합된 것으로 판단된다. 그러나 이들 물질간 정확한 혼합비율을 계산하기 위해서는 연구지역 내 시료에 대한 추가적인 Sr 농도 및 동위원소 분석이 필요하다. 두 개체군 간 벌크 87Sr/86Sr 비에 대한 t-test 결과, t = 2.93 (p < 0.05)로 통계적으로 유의한 차이를 보였다. 따라서 벌크 87Sr/86Sr 비로는 자연 생육 감태와 인공 이식된 감태의 분류가 가능한 것으로 판단된다.
각 부위별 t-test 분석 결과, 뿌리(t = 1.89, p > 0.05), 줄기(t = 1.02, p > 0.05), 잎(t = 3.76, p < 0.05)으로 특히 잎 부위에서 두 개체군 간 통계적 유의성이 존재하였다. 해당 특성은 두 개체군의 해양 환경 내 서식 기간 차이로 해수로부터 흡수되는 혼합비율의 차이가 발생하는 것으로 판단된다. 따라서 자연 생육 감태와 인공 이식된 감태의 87Sr/86Sr 비는 통계적 유의미한 차이를 가지며, 특히 잎에 대한 87Sr/86Sr 비 분석을 통해 성공적으로 두 개체군간 구분이 가능할 것으로 판단된다.
4. 결 론
이번 연구에서는 동해안 해역에서 채취한 자연 생육 감태와 인공 이식 감태에 대한 무기화학조성과 87Sr/86Sr 비 분석을 통해 두 개체군간, 각 부위별 화학적 특성을 비교하고, 이를 통해 자연 생육 감태와 인공 이식 감태의 구별 가능성을 평가하였다. 두 개체군의 무기화학조성은 감태 생장에 따른 생물학적 특성을 반영한 반면 87Sr/86Sr 비는 부착된 암석 및 인공어초와 해수의 혼합 특성을 반영하였다. 특히, 잎 부위에서 87Sr/86Sr 비에서 통계적으로 가장 유의미한 차이를 보였다. 이번 연구를 통해 87Sr/86Sr 비는 자연 생육 감태와 인공 이식 감태를 분류하는 데 유용한 도구로써 사용될 수 있음을 확인하였고, 향후 보다 정확한 두 감태 개체군을 분류하기 위하여 성숙한 두 개체군별 비교, 자연 암반 및 인공 어초의 87Sr/86Sr 비 등의 추가적인 자료 확보가 필요할 것으로 판단된다.