1. 서 론: 연구의 개요
2. 감염성 해양바이러스 연구의 필요성
3. 국내외 연구개발 현황
4. 연구개발의 목표 및 내용
5. 주요 연구 성과 및 결과
5.1 감염성 해양바이러스 빅데이터 구축 및 데이터 마이닝 기술 개발
5.2 핵산/항체 기반 감염성 바이러스 진단기술 개발
5.3 감염성 바이러스 감염모델 개발
5.4 항바이러스 전략 소재 발굴
5.5 광범위 항바이러스 치료제 개발
6. 연구개발 성과의 활용방안 및 전망
1. 서 론: 연구의 개요
바이러스에 의한 인간감염 및 대량사멸의 역사는 오래된 일이고, 바이러스 관련 연구가 수행될수록 바이러스성 질병의 발견 빈도가 증가하고 있고, 피해 정도도 크게 증가하고 있다(Chappell and Dermody, 2015; Piret and Boivin, 2021). 예를 들면, 15,000명이 감염된 웨스트나일 바이러스(West Nile virus, WNV, 1937년), 1,553명이 감염된 에볼라 바이러스(Ebola virus, EBOV, 1976년) 및 약 15,000명이 감염된 것으로 보고된 신종인플루엔자(Influenza A, H1N1, 2009년) 등이 팬데믹을 유발한 바 있다. 특히 21세기에 전세계적인 팬데믹을 일으키고 있는 사스(Severe Acute Respiratory Syndrome Coronavirus, SARS-CoV), 메르스(Middle East Respiratory Syndrome Coronavirus, MERS-CoV)에 이은 코비드-19 (Coronavirus disease 2019, COVID-19), 즉 신종 코로나 바이러스는 2022년 12월 기준 6억 5천 만명 이상 감염, 660만명 이상의 사망자가 보고되고 있으며, 경제적 피해는 추산할 수 없을 만큼 막대한 것으로 알려지고 있다(Piret and Boivin, 2021; Pustake et al., 2022).
세계보건기구(World Health Organization, WHO)에서는 COVID-19를 포함하여 주의해야 할 바이러스성 질병의 목록을 게시하고, 인간, 동물 및 환경이 건강해야 감염병을 관리할 수 있다는 원헬스 기반 관리방안을 제시하고 있다(Ellwanger et al., 2021; Keusch et al., 2022). 특히 WHO에서는 미래에 새로운 팬데믹을 유발하여 수백만명 이상의 사망자를 유발할 수 있는 미지의 바이러스성 감염병을 Disease X로 명명하고, Disease X에 대비하여야 함을 강조하고 있다(Chatterjee et al., 2021). 미래에 올 수도 있는 미지의 팬데믹에 대비하기 위해서는 감시, 진단, 치료, 대비 또는 예방을 준비하여야 하며, 선진국을 중심으로 미래 팬데믹에 대비하고 있다. 특히 미국 보건복지부는 소위 아폴로 계획(American Pandemic Preparedness)을 발표하여, 백신, 치료제, 진단 기술 개발 등에 10년간 653억 달러의 예산을 투입하기로 결정한 바 있다(Chiu et al., 2023).
우리나라도 질병관리본부, 농림축산검역본부, 국립환경과학원 등이 참석한 인수공통 감염병 대책위 회의에서 원헬스 기반 선제적 탐색기술, 고감도 휴대형 진단, 광범위 감염병 치료제 개발, 백신 개발 등을 논의한 바 있다. 그러나 해양과 관련된 논의는 없었으며, 해양수산부는 대책위에 포함되어 있지 않았다. 지구생물의 80% 이상이 서식하는 해양으로부터의 신종감염병 발생 확률은 매우 높을 것으로 추측되는데, 해양수산부의 역할은 무엇인지 정리가 필요한 시점이라고 판단된다. 국가 감염병 위기대응 기술개발 추진전략 회의에서 13개 중점 추진과제를 설정하고 있으나, 여기에서도 해양의 역할은 없었다. 본 연구팀은 전술한 바와 같이 지구상에서의 해양의 중요성에도 불구하고 해양수산부가 미래 감염병 대응에 있어서 주요 이니셔티브를 가져야 한다고 판단하고 있다.
실제로 아데노바이러스(Adenovirus)에 의한 간괴사증, 칼리시바이러스(Calicivirus)에 의한 피부수포증, 헤르페스바이러스(Herpesvirus)에 의한 폐렴 및 식욕부진, 인플로엔자 바이러스(Influenza virus)에 의한 독감, 폭스바이러스(poxviruses)에 의한 피부병 등이 해양포유류에서 확인되고 있으며, 랍도바이러스(Rhabdovirus), 레오바이러스(Reovirus), 노다바이러스(Nodavirus), 니마바이러스(Nimavirus) 등 이머징 바이러스의 해양 출현 관련 연구가 급증하고 있다(Zhang et al., 2022; Marie and Gordon, 2023). 특히 Tara Ocean Project 등을 통하여 20만여종 이상의 해양바이러스가 존재함이 보고되었고, 5,500여종의 해양 RNA 바이러스가 인수공통 후보 바이러스가 될 수 있음이 제안된 바 있다(Marx, 2022). 따라서 감염병의 국가 관측, 정보 공유 및 미래 대응을 위하여 감염성 해양바이러스 빅데이터 구축, 가시화 및 데이터 마이닝 기술 개발이 요구되고 있다(Bansal et al., 2016; Chen et al., 2018). 조기경보, 해양생물 및 국민 건강 보호, 사회/경제적 손실 최소화를 위하여 신속하고 정확한 현장적용형 감염성 바이러스 진단기술 및 항바이러스 치료제 개발이 필요하다(Khodaparast et al., 2024). 해양 기인 바이러스성 감염병에 대한 사전 대비 능력 확보를 위하여, 감염성 바이러스 감염모델 개발 및 항바이러스 소재탐색을 수행하여, 미래 해양 기인 감염병 관리 및 해양생태계 보존을 위한 국가 대응전략을 설계하고자 하는 것이 본 연구의 필요성으로 요약할 수 있다(Fig. 1).
2. 감염성 해양바이러스 연구의 필요성
해양은 전 세계 바이러스의 가장 큰 저장소 중 하나로, 약 1030개의 바이러스가 존재하는 것으로 추정되고 있다(Suttle, 2007). 해양바이러스는 주로 박테리오파지(bacteriophages)로 구성되지만, 일부는 해양 진핵생물을 감염시켜 생태계 및 인간 건강에 심각한 영향을 미칠 수 있다(Danovaro et al., 2011). 해양바이러스 중 일부는 인간에게 전염되어 인수공통감염병(zoonotic diseases)을 유발할 가능성이 있어, 이에 대한 대비와 연구가 시급하다(Woolhouse and Gaunt, 2007). 또한 해양바이러스의 출현은 기후 변화, 해양 오염, 그리고 인간 활동 증가와 밀접하게 연관되어 있다(Breitbart et al., 2018). 특히, 해양 온도 상승은 바이러스의 감염력과 증식률을 높이는 요인으로 작용한다(Middelboe and Brussaard 2017). 감염성 해양바이러스는 해양 생물의 집단감소를 유발하여 생태계 교란을 초래하며, 해양 기원의 바이러스 중 일부는 인간에게 직접 또는 간접적으로 전파될 수 있다. 예를 들어, A형 간염 바이러스(Hepatitis A virus, HAV)와 같은 바이러스 역시 해양 오염을 통해 확산되어 공중보건 문제를 일으킬 수 있다(Pintó et al., 2007). 기후 변화로 인한 해수 온도 상승과 해류 변화는 해양바이러스의 확산을 촉진한다. 이러한 변화는 바이러스의 서식 범위를 확장시키고, 새로운 해양바이러스의 출현 가능성을 높인다(Mojica and Brussaard, 2014).
해양 환경은 미생물과 바이러스의 주요 서식지이며, 이들 중 일부는 인간과 동물 간에 전파될 수 있는 인수공통 감염병을 유발한다(Suttle, 2005). 최근 해양 생태계 변화와 인간 활동의 증가로 인해 해양 기인 인수공통 바이러스(zoonotic viruses)의 출현 및 확산 위험이 증가하고 있다(Danovaro et al., 2011). 이러한 위험을 평가하고 효과적인 대비 전략을 마련하는 것이 시급하다. 해양바이러스는 어류, 해양 포유류, 연체동물 등을 숙주로 삼아 증식(복제)하며 일부는 인간에게 직접적으로 또는 오염된 식품을 통해 전파된다(Koonin and Dolja, 2013). 대표적으로 노로바이러스(Norovirus)와 A형 간염 바이러스는 오염된 조개류를 통해 인간에게 감염되며 위장관 질환을 유발한다(Bosch et al., 2016). 해양 생물과 인간의 접촉 빈도가 증가하면서 새로운 인수공통 바이러스가 출현할 가능성도 커지고 있다. 예를 들어, 해양 포유류에서 발견된 모빌리바이러스(Morbillivirus)는 돌고래 및 물개를 숙주로 하며, 인간 감염 가능성에 대한 우려가 제기된 바 있다(Van Bressem et al., 2014). 기후 변화로 인해 해양 온도가 상승하고 해류 패턴이 변화하면서 바이러스의 분포가 확산되고 있다(Burge et al., 2014). 피코르나바이러스(Picornavirus)와 같은 해양 바이러스는 높은 수온에서 증식 속도가 증가하며 감염 위험을 높인다(Danovaro et al., 2011). 또한, 빙하 해빙으로 인해 오래된 바이러스가 방출되어 해양 생태계와 인간에게 새로운 위험을 가져올 수 있는 것으로 알려지고 있다(Legendre et al., 2014). 오염된 해산물은 해양 기인 인수공통 바이러스의 주요 감염원이다. 특히, 굴과 조개에서 검출된 노로바이러스는 전 세계적으로 식중독 발생의 주요 원인이 되고 있으며(Lees, 2000), 어류 관련 바이러스성 출혈성 패혈증 바이러스(Viral hemorrhagic septicemia virus, VHSV) 역시 어류 및 수산물을 통해 인간에게 전파될 가능성이 존재한다(Baillon et al., 2020).
Disease X는 세계보건기구가 정의한 개념으로, 현재 알려지지 않은 병원체가 미래에 인간에게 전염되어 팬데믹을 일으킬 가능성을 의미한다(Mehand et al., 2018). 최근 급증하는 인수공통감염병, 기후 변화, 인구 증가, 그리고 글로벌화로 인해 Disease X의 출현 가능성은 더욱 높아지고 있으며, 이에 대비한 전략 마련은 글로벌 보건 안보의 핵심 과제가 되고 있다(Dobson et al., 2020). 또한 Disease X는 기존에 알려지지 않은 병원체 또는 기존 병원체의 변이로 인해 발생할 수 있다(Woolhouse and Gowtage-Sequeria, 2005). 과거 SARS-CoV와 MERS-CoV, 그리고 최근 COVID-19의 사례에서 볼 수 있듯이, 인수공통 바이러스의 돌연변이나 생태적 변화가 새로운 감염병 출현의 주요 원인이 될 수 있다. 특히, 바이러스 재조합 및 변이는 병원체의 감염력과 전파력을 높일 수 있어 위험한 것으로 평가되고 있다(Markov et al., 2023). 기후 변화는 질병의 출현과 확산에 큰 영향을 미친다. 온도 상승과 서식지 변화로 인해 새로운 병원체의 생태적 분포가 바뀌며, 인간과 동물의 접촉 빈도가 증가하고 있다(Harvell et al., 2002). 에볼라 바이러스(Ebola virus)와 니파 바이러스(Nipah virus)는 이러한 환경 변화의 영향으로 출현했으며, 이는 Disease X의 위험성을 더욱 부각시키고 있다(Jones et al., 2008). 또한, 도시화와 삼림 파괴로 인해 야생 동물의 서식지가 축소되면서 병원체가 인간에게 전파될 가능성이 높아졌다(Allen et al., 2017). Disease X는 높은 전염성과 치명률을 가질 수 있는 잠재적 감염병이다. 예를 들어, 인플루엔자 바이러스는 사람 간 빠르게 전파되며, 특정 변이는 치명적인 결과를 초래할 수 있다(Taubenberger and Morens, 2006). 이러한 특성을 가진 병원체가 등장할 경우, COVID-19와 같은 팬데믹보다 더 큰 위협이 될 수 있음이 경고되고 있다(Morens and Fauci, 2020).
감염성 해양바이러스의 출현과 확산을 조기에 탐지하기 위해 해양 감시 시스템을 구축해야 한다. 첨단 메타게놈 분석(metagenomics)과 바이러스 유전체 서열 분석 기술을 통해 새로운 해양바이러스의 출현을 신속하게 탐지할 수 있다(Gregory et al., 2019). 예를 들어, 해수 및 해양 생물 시료를 분석하여 바이러스 다양성과 변이를 추적해야 한다(Roux et al., 2016). 또한 해양 오염을 줄이고 건강한 해양 생태계를 유지하는 것이 해양 바이러스의 확산을 억제하는 중요한 전략이다(Halpern et al., 2008). 폐수 처리 및 중금속, 미세 플라스틱 오염 방지를 통해 해양 바이러스의 증식을 억제할 수 있다(Galloway and Lewis, 2016). 인수공통 감염 위험이 있는 해양바이러스에 대해 백신 및 치료제를 개발해야 한다. 예를 들어, HAV와 노로바이러스와 같은 해양 기원의 감염병에 대해 기존 백신의 적용성을 확대하거나 새로운 백신 플랫폼을 개발하는 것이 필요하다(Rodrigues and Plotkin, 2020). 오염된 해산물은 주요 감염 경로이므로, 해산물 위생 및 유통 관리를 강화해야 한다. 식품 안전 검사 시스템과 위생 기준을 준수하여 바이러스의 전파를 차단해야 한다(Lees, 2000). 또한 해양 생태계 보호를 위해 인간 활동을 규제하고, 해양 오염을 줄이는 정책이 요구되며, 동시에 기후 변화에 따른 해양 바이러스 위험성 평가를 지속적으로 수행해야 한다(Patz et al., 2004).
3. 국내외 연구개발 현황
감염성 해양 바이러스는 해양 생태계 및 공중보건에 중대한 영향을 미치는 요소로, 이에 대한 연구는 국가별로 다양한 전략과 기술을 통해 진행되고 있다. 주요 국가들은 빅데이터를 활용한 해양 바이러스의 다양성과 병리학적 역할 연구를 중심으로 진단, 치료제 개발, 감염 모델 구축에 이르기까지 폭넓은 연구를 진행하고 있다(Suttle, 2007; Gregory et al., 2019). 감염성 해양바이러스에 관한 연구는 육상 바이러스 연구에 비해 상대적으로 부족하고, 대부분의 연구는 일부 해양 수산물의 검역바이러스에 집중되어 있다. 또한 해양바이러스 감염 기작 관련 연구도 육상바이러스 연구에 비해 매우 미흡한 실정이며, 단순 감염 확인 이외에 세포 배양(in vitro) 또는 동물모델(in vivo) 기반 감염 연구는 거의 이루어지지 않고 있다(Middelboe and Brussaard, 2017; Vincent and Vardi, 2023).
미국은 해양 바이러스 연구에서 선도적인 역할을 하고 있으며, 특히 해양 바이러스 빅데이터 구축 및 분석에서 뛰어난 성과를 보이고 있다. 미국의 Tara Oceans 프로젝트는 전 세계 해양 바이러스 유전체 데이터를 수집하고 분석하는 데 중추적 역할을 하고 있다(Gregory et al., 2019). 이 데이터는 메타게놈 분석과 머신러닝 기법을 통해 해양 바이러스의 군집 구조와 생태적 역할을 밝히는 데 활용되고 있다(Rasmussen et al., 2022). 또한, 미국은 CRISPR-Cas 시스템과 같은 혁신적 유전자 편집 기술을 활용해 바이러스 진단 기술과 치료제를 개발하고 있으며, 이를 통해 양식 산업에서 발생하는 바이러스성 질병 문제 해결에 기여하고 있다(Koonin and Dolja, 2013). 캐나다의 연구진들은 해양생물에 대한 COVID-19의 영향 관련 연구를 통해 SARS-CoV-2가 하수 및 폐수를 통해 고래와 다른 해양 포유류에 전파될 수 있음을 시사하였다. 현재까지, 해양포유류에서 COVID-19의 실제 사례가 알려진 바 없으나, 이들 세포에 인간과 유사한 코로나바이러스의 수용체를 갖고 있어 바이러스 감염 가능성을 확인하였고, 일부 멸종위기에 처한 돌고래에서 위험성이 강조되고 있다(Mathavarajah et al., 2021). 유럽은 국제 협력 기반의 대규모 해양 연구 프로젝트를 통해 바이러스 생태학 및 유전체학 연구를 이끌고 있다. 특히, Tara Oceans 프로젝트는 유럽 연구기관의 적극적인 참여로 운영되고 있으며, 북대서양과 지중해의 해양 바이러스 군집 구조 및 생물지리학적 패턴을 분석하는 데 기여하였다(Roux et al., 2016). 유럽연합(EU)은 바이러스 감염 모델 및 환경 변화가 바이러스와 숙주 간 상호작용에 미치는 영향을 시뮬레이션하는 연구에 집중하고 있다. 이를 위해 인공지능(AI)과 데이터마이닝 기술을 통합하여 환경 변화 시나리오에서 바이러스 확산을 예측하는 모델을 개발하고 있다(Rasmussen et al., 2022).
중국은 해양 자원의 산업적 활용과 공중보건을 위한 감염성 해양 바이러스 연구를 활발히 수행하고 있다. 특히, 중국은 남중국해와 황해를 포함한 지역 해양환경에서 메타바이롬 데이터를 수집하고 있으며, 이를 통해 지역 바이러스 군집의 특성과 병원성 바이러스의 분포를 분석하고 있다(Volpe et al., 2023). 중국은 또한 해양 생물에서 유래한 천연 항바이러스 소재 개발에 주력하고 있으며, 해조류 및 해양 미생물에서 추출한 화합물을 기반으로 신약 개발을 추진하고 있다(Liang et al., 2019). 일본은 해양 바이러스와 숙주 미생물 간의 상호작용 연구에 중점을 두고 있다. 특히, 일본 연구팀은 일본 연안 해역의 바이러스-미생물 네트워크를 분석하여, 특정 바이러스가 미생물 군집의 기능 및 생태계에 미치는 영향을 연구하고 있다(Tominaga et al., 2023). 진단 기술 측면에서는 환경 DNA (eDNA)와 메타게노믹스 분석을 결합하여 해양 바이러스 감염 조기 경보 시스템을 구축하고 있다. 이는 일본의 양식업에 중요한 역할을 하고 있으며, 바이러스성 질병의 확산을 효과적으로 억제하고 있다(Roux et al., 2016). 한국은 해양 바이러스의 다양성 및 병리학적 역할 연구를 위한 데이터마이닝 기술 개발에 집중하고 있다. 대학과 정부출연기관에서 해양바이러스와 관련한 연구를 수행해 왔으나, 특정 바이러스의 새로운 보고나 검출방법에 대해 초점을 두었고, 숙주와 바이러스성 병원체에 대한 체계적이고 다각적인 연구는 수행된 바 없다. 한국 연구팀은 동해와 서해를 중심으로 메타바이롬 데이터베이스를 구축하고 있으며, 이를 통해 환경 변화가 바이러스 군집에 미치는 영향을 분석하고 있다(Jung et al., 2023; Shin et al., 2024). 또한, 한국은 항바이러스 소재 개발에서도 주목할 만한 성과를 내고 있다. 해양 미세조류와 해조류에서 유래한 유용성분을 기반으로 항바이러스 소재 개발 연구를 적극적으로 추진하고 있다(Kang et al., 2024; Kim et al., 2024).
4. 연구개발의 목표 및 내용
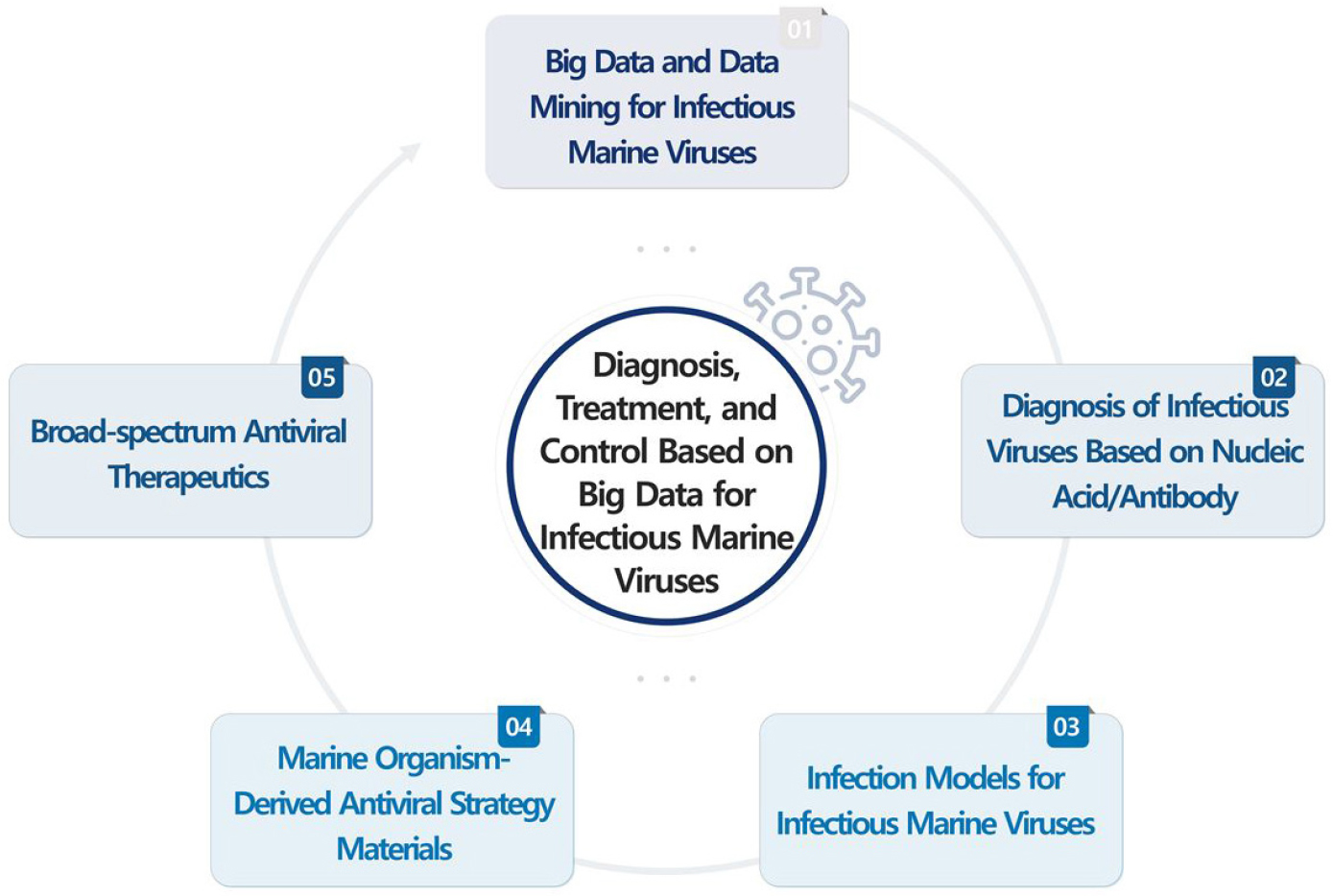
본 연구의 목표인 감염성 해양바이러스 빅데이터 기반 진단, 치료 및 제어기술을 개발하기 위하여, 1) 감염성 해양바이러스 빅데이터 구축 및 데이터 마이닝 기술 개발, 2) 핵산 및 항체 기반 감염성 해양바이러스 진단 기술 개발, 3) 감염성 해양바이러스 감염 모델 시스템 개발, 4) 해양생물 유래 항바이러스 전략 소재 발굴, 5) 광범위 항바이러스 치료제 개발 등 5개의 세부 연구를 구성하였다. 이를 통하여 해양 기인 미래 팬데믹을 유발할 수 있는 잠재적인 Disease X 목록을 작성하고, 국가 대응 플랫폼을 구축하고자 하였다.
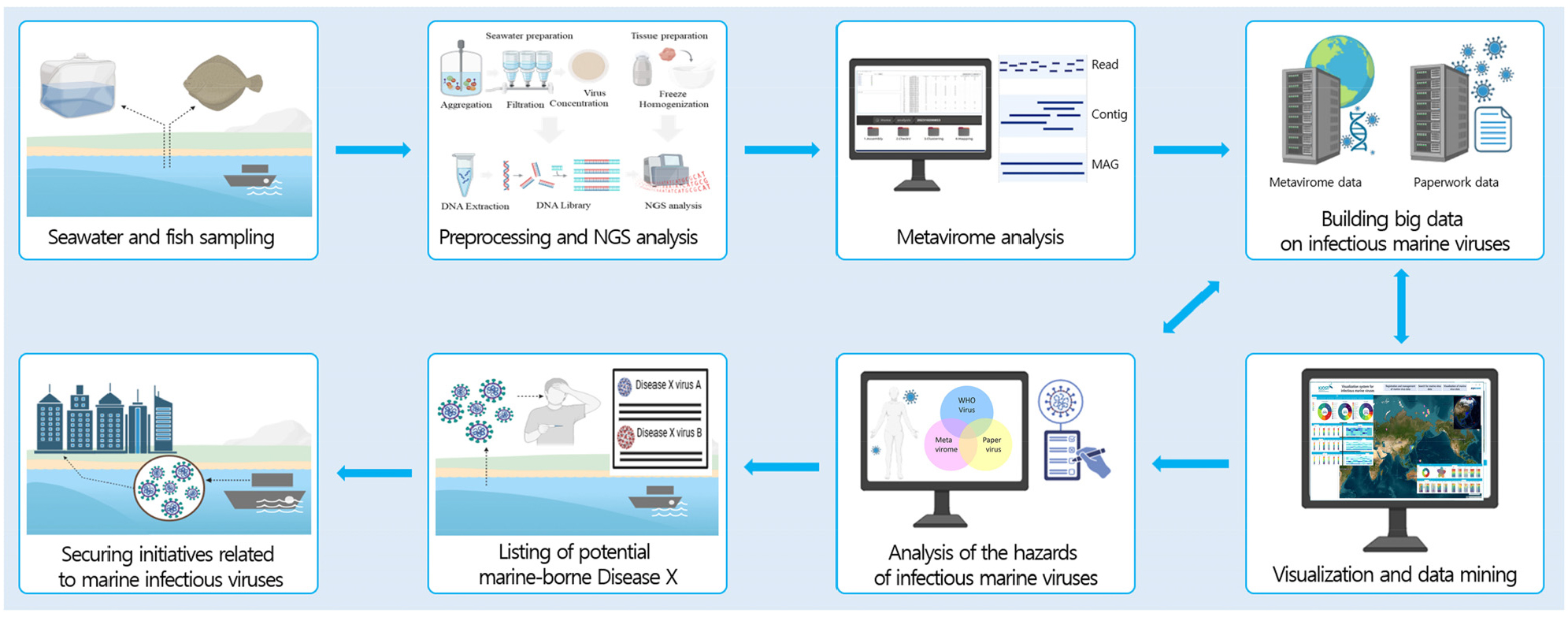
감염성 해양바이러스 빅데이터 구축 및 데이터 마이닝 기술 개발을 위하여, 인간 활동이 활발한 지역(항만, 해수욕장 등), 분포 범위가 넓은 해양생물의 출현이 잦은 지역(철새도래지), 자연 해류 이동해역(제주도, 울릉도, 독도, 동해, 서해 등)의 해수와 감염성 해양바이러스의 숙주로서 인간과 밀접한 관계에 있는 해양수산물을 대상으로 Metavirome 분석을 수행하였다. 이를 통하여 해양바이러스의 빅데이터를 구축하고, 잠재적 감염성 해양바이러스의 목록을 추출하여, 이들의 분포와 풍부도를 가시화함으로써 감염성 질환 확산의 경보 및 조기 예방 체계를 마련하고자 하고자 하였다(Fig. 2).
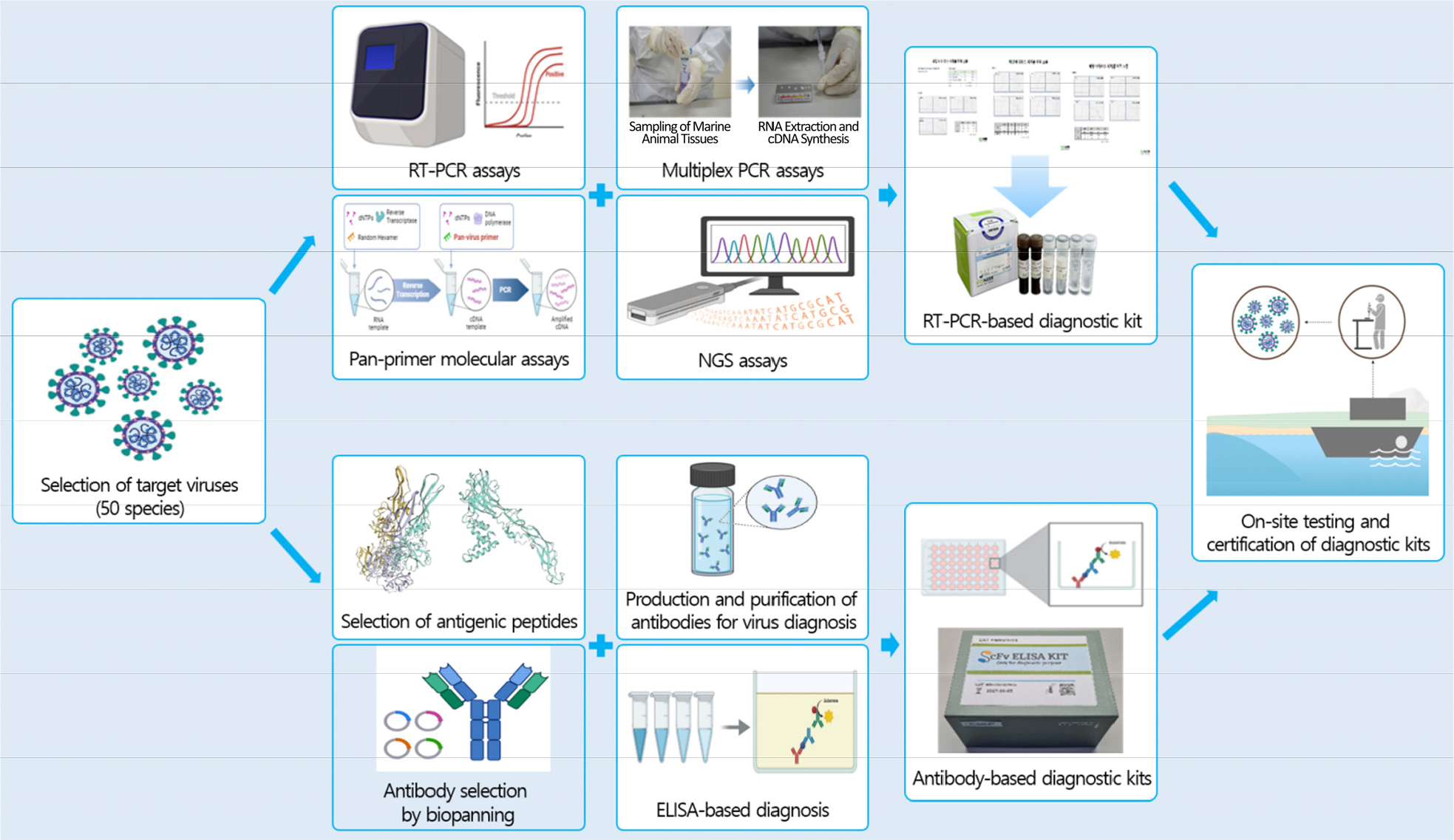
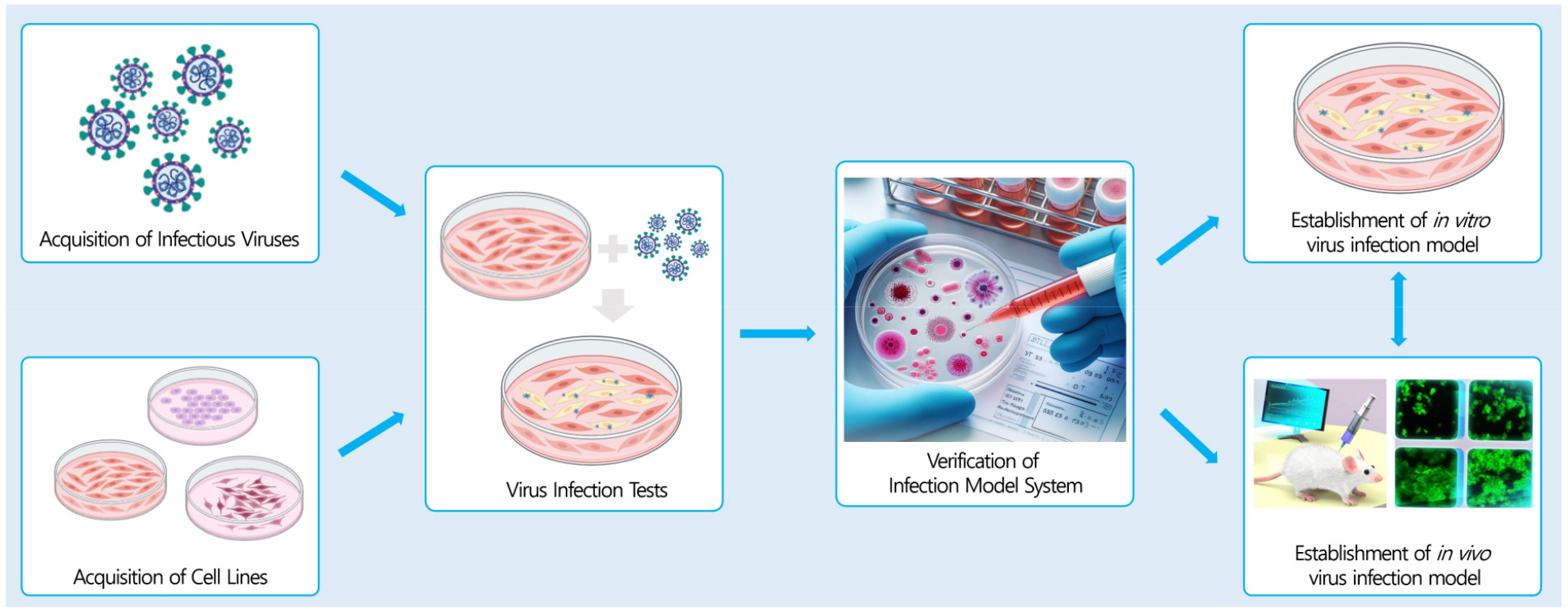
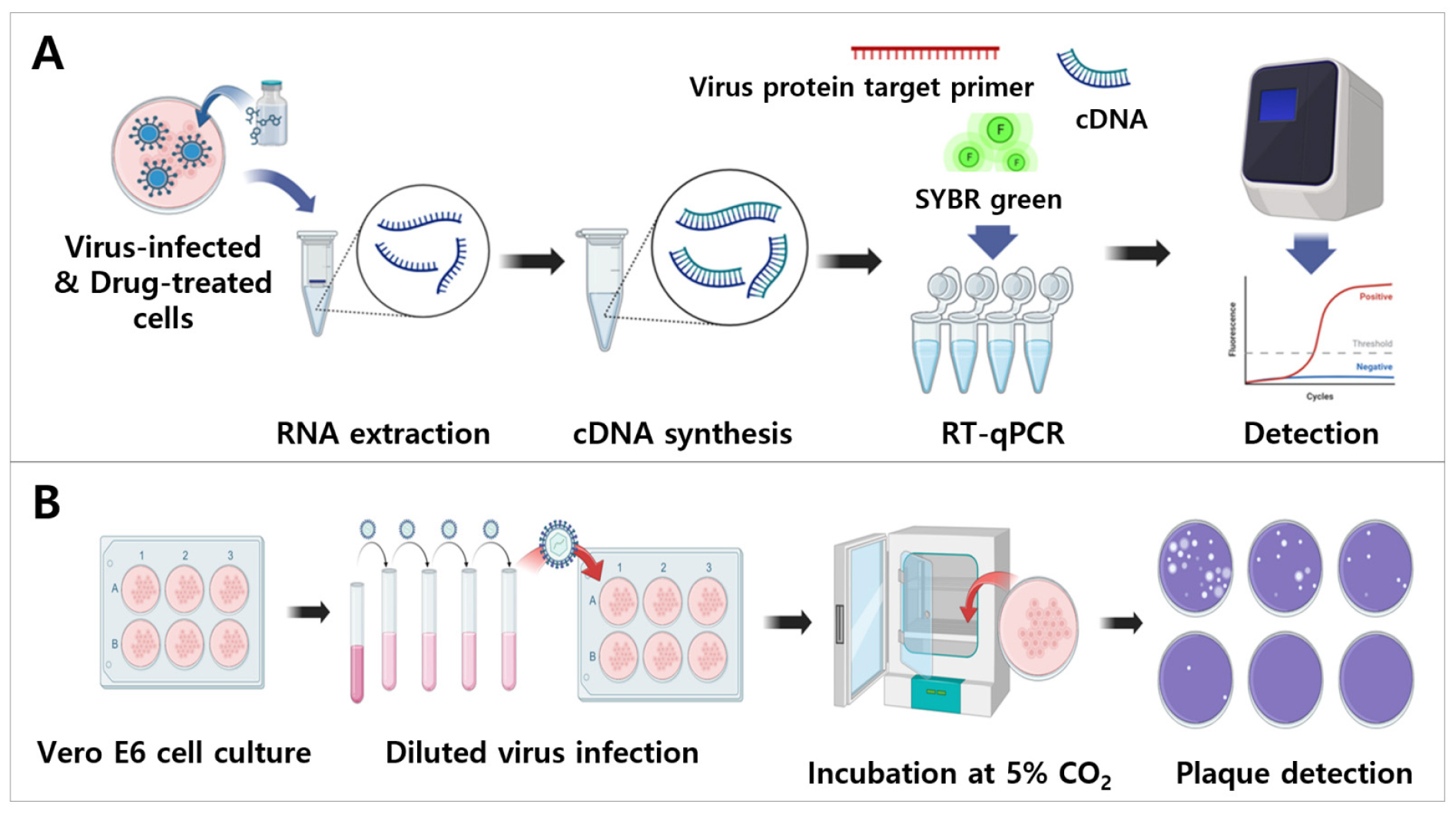
바이러스의 진단 기술 개발은 방역 시스템의 기반이 되는 가장 중요한 기술임에도 불구하고, 현재 감염성 해양바이러스에 대한 진단 개발 연구는 육상 바이러스 연구에 비해 상대적으로 미흡한 상황이다. 따라서 핵산 기반 정밀진단 기술 및 항체 기반 현장적용 기술 개발로 쉽고 빠른 바이러스의 진단을 통해 감염성 해양바이러스 대응 시스템 기반 마련하고자 하였다(Fig. 3). 또한 해양 유래 인수공통 바이러스 대응을 위한 잠재 바이러스의 감염 및 생활주기 특성 분석 연구 진행 및 해양바이러스 감염 및 특성 분석 기반 기술을 확립하여 차후 다양한 바이러스에도 이용할 수 있도록 감염 시스템을 개발하고자 하였다(Fig. 4).
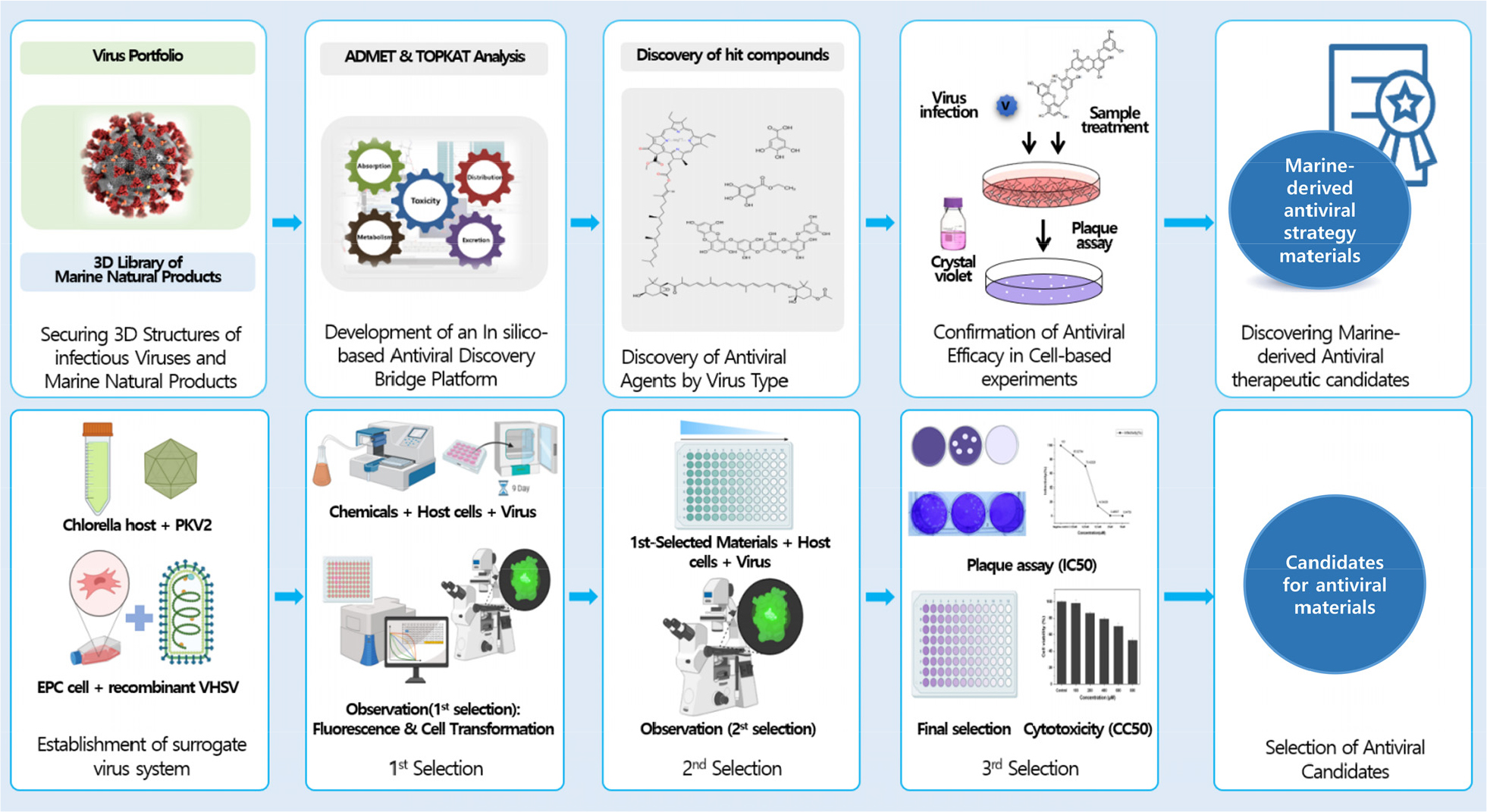
병원체를 예측할 수 없는 해양바이러스에 대하여 즉각적인 스크리닝이 가능한 in silico 기반 항바이러스 해양소재 발굴용 Drug Discovery Bridge Platform과 배양이 어렵거나 감염 위험성이 높은 바이러스를 대체하여 쉽고 빠르게 항바이러스 효능을 스크리닝할 수 있는 surrogate virus screening system을 개발하고, 이를 통해 해양생물 유래 항바이러스 전략 소재를 발굴하고자 하였다(Fig. 5). 또한 구축된 해양생물 유래 항바이러스 전략소재 도출 기술은 항바이러스 소재 발굴 목적 외 각종 기능성을 목적으로 하는 소재 발굴에도 적용 가능하도록 디자인하였다.
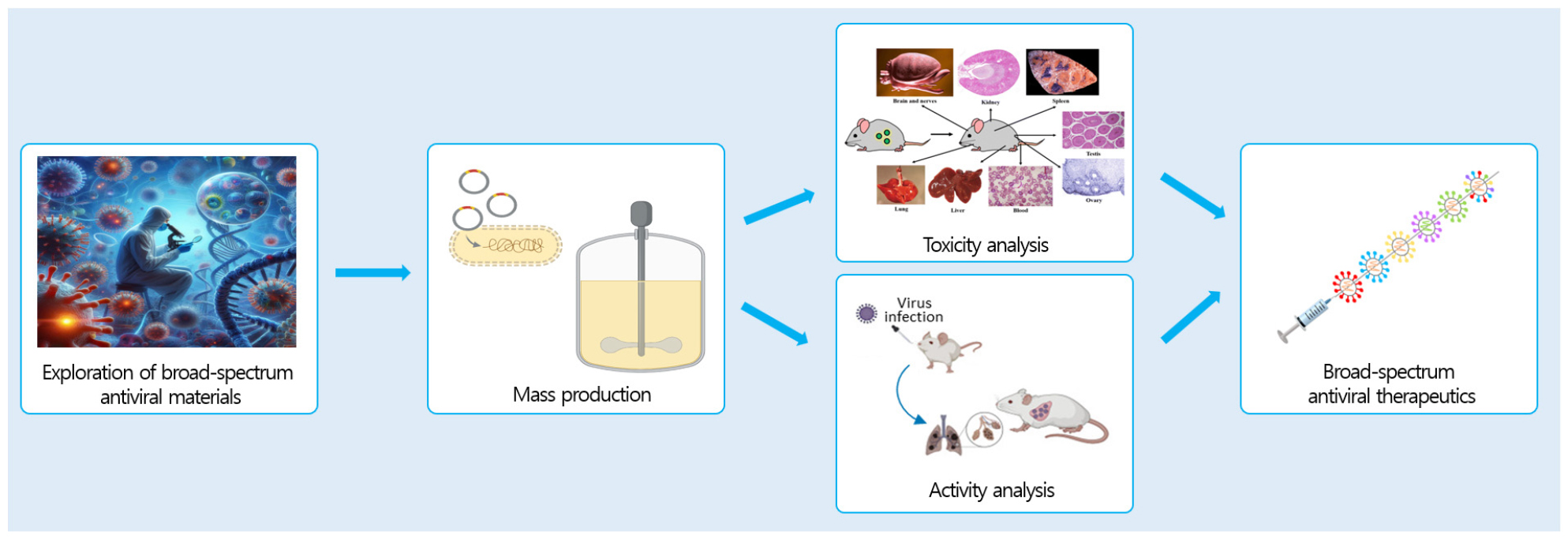
항바이러스 활성을 지닌 항체기반 소재를 활용하여 광범위 활성을 지닌 항바이러스 치료제를 개발함으로써 향 후 발생 가능 감염성 질환에 대비하고자 하였다. 본 연구를 통하여 대상 항체 기반 소재에 대한 선도물질 최적화 작업 및 후보물질 선정, 항바이러스 치료제의 개발 및 공정 확보, 독성 및 효능 평가 등을 수행하여 항바이러스 치료제 개발을 완료하고자 하였다(Fig. 6). 개발된 항바이러스 치료제는 바이러스에 감염된 세포 내부로 침투하여 바이러스 핵산을 가수분해 함으로써 증식을 억제하고 사멸을 유도한다.
5. 주요 연구 성과 및 결과
5.1 감염성 해양바이러스 빅데이터 구축 및 데이터 마이닝 기술 개발
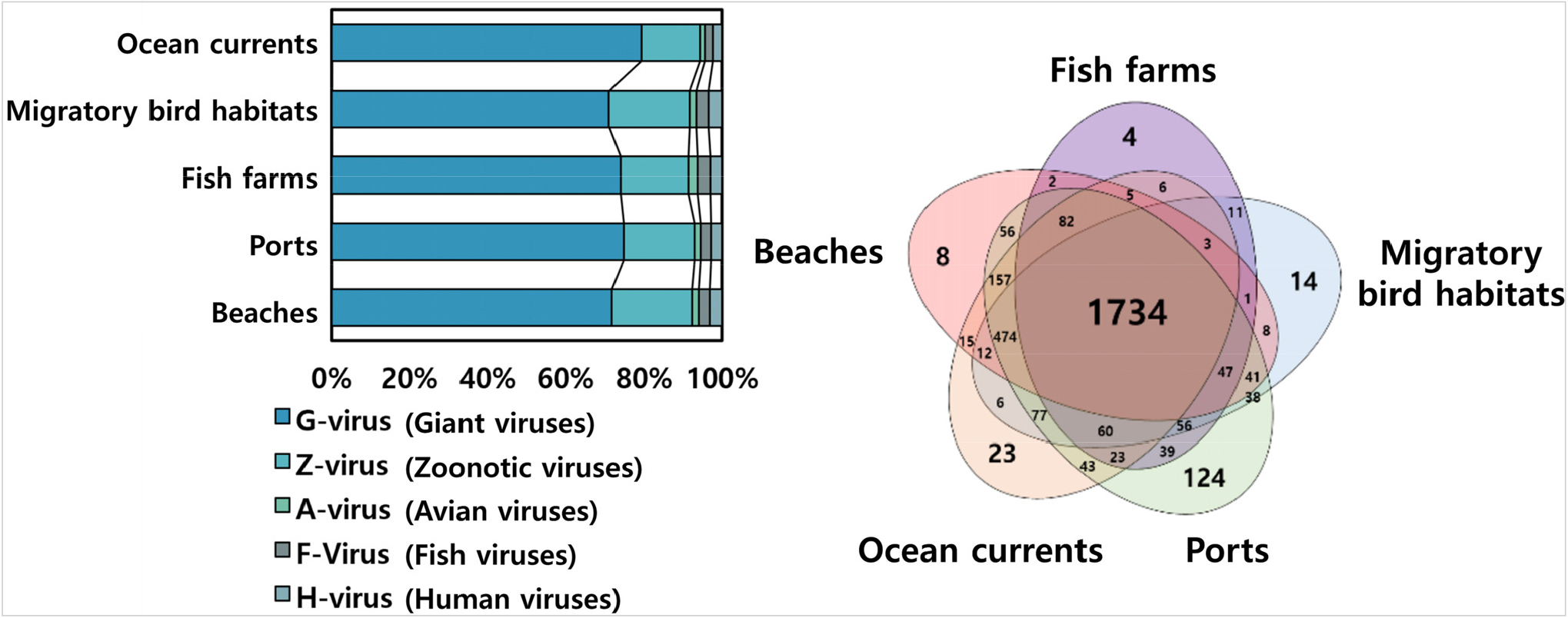
감염성 해양바이러스 빅데이터 구축 및 데이터 마이닝 기술 개발을 위하여 해양시료 분석, 감염성 해양바이러스 메타바이롬 분석 및 지리정보시스템(geographic information system, GIS) 기반 가시화 및 글로벌 맵 구축 등 3개의 연구분야를 설정하였다. 해양시료 확보 및 메타바이롬 분석을 위하여 해류, 항만, 철새도래지, 해수욕장, 양식장 및 대양을 중심으로 정점을 선정하였다. 감염성 해양바이러스는 거대바이러스(giant virus, G-virus), 인수공통 바이러스(zoonotic virus, Z-virus), 조류 바이러스(avian virus, A-virus), 어류 바이러스(fish virus, F-virus) 및 인간 바이러스(human virus, H-virus)로 구분하여 분석하였다.
메타바이롬 분석을 최적화하기 위한 연구를 수행하였으며, 기존의 40여시간 이상 소요되었던 분석 시간을 바이러스 분석 소프트웨어 자체 개발을 통해 12시간 이내로 크게 단축시켰다. 1-2단계(2021-2024년) 연구를 수행하면서 690건의 해양시료를 채집하였고, 5,000 bp 이상 품질 검사된 약 50만개의 유전체 데이터로부터 74과 2,885종의 감염성 해양 DNA 바이러스 목록을 확보하였다(Fig. 7). 감염성 해양 RNA 바이러스 분석을 위하여 34건의 해양시료를 분석하였으며, 약 1만개의 유전체 데이터로부터 20과 431종의 목록을 확보하였다. 기존에 알려진 감염성 해양바이러스 인벤토리를 구축하기 위하여 웹 및 20,000건의 연구논문을 분석하였다. 이를 통하여 65과 1,101종의 감염성 해양바이러스 목록을 작성하였다. 메타바이롬 분석 결과와 문헌 기반 인벤토리 목록을 통해 도출된 감염성 해양바이러스의 위해성 평가를 위한 중요한 기준을 제공하게 될 것이다.
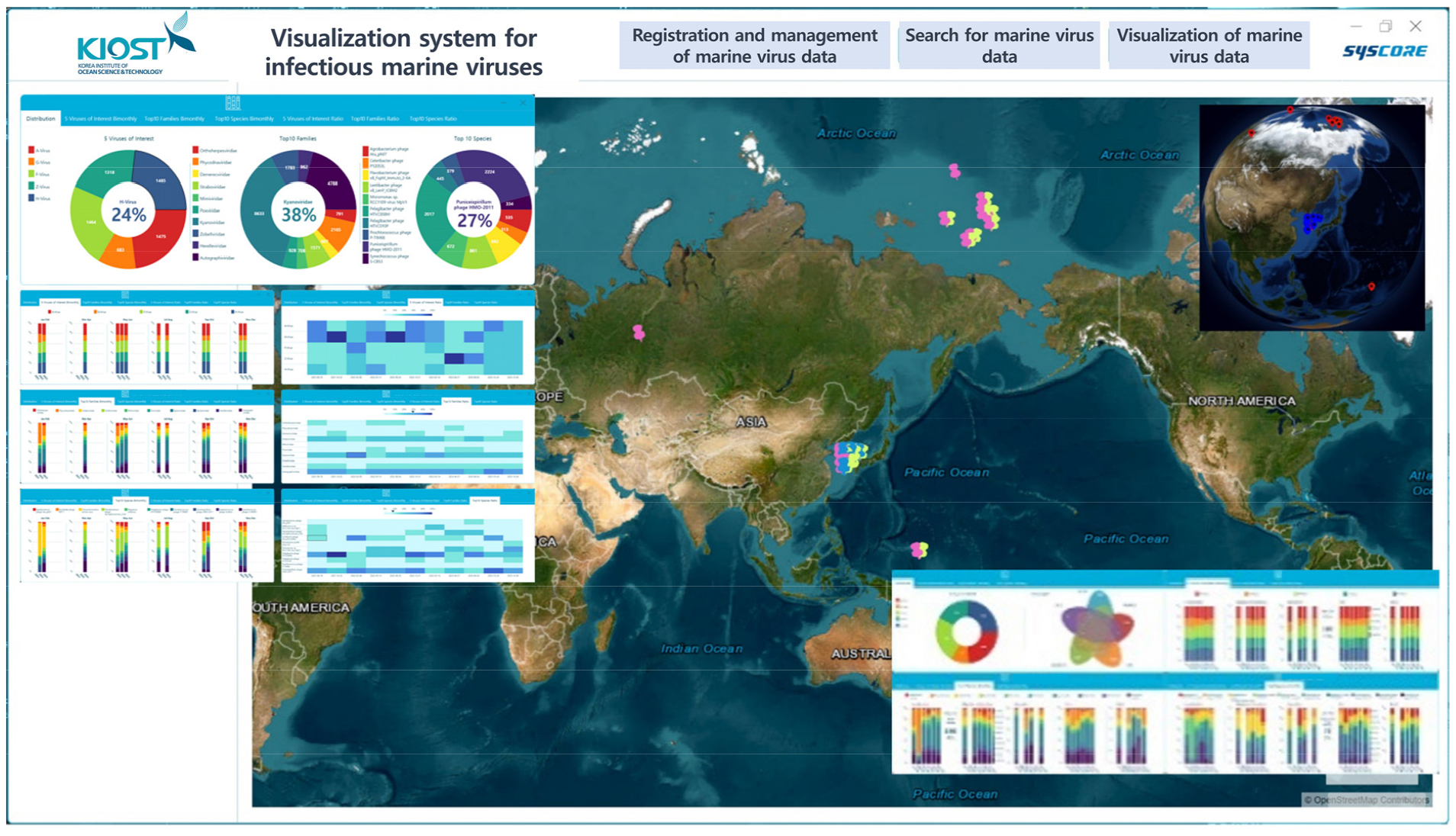
감염성 해양바이러스 빅데이터 구축을 위하여 지리정보시스템(GIS) 기반 가시화 프로그램을 개발하였으며, 글로벌 맵을 구축하였다(Fig. 8). 빅데이터 기반 데이터마이닝을 위하여 유전체 정보로부터 필요로 하는 자료를 얻을 수 있도록 one-step processing 분석 시스템을 개발하였다. 이 분석 프로그램은 유전체 기본 데이터(Raw sequencing files)에서 low-quality 유전자(<50 bp) 및 adaptor 제거 후에 유전체 조립(assemble), Virus quality check, Read mapping 및 taxonomic profiling을 과정을 연속적으로 분석하는 프로그램으로 GIS 기반 가시화 프로그램과 연동되어 유전체 분석과 함께 가시화가 가능하도록 구성하였다. 바이러스 분석 소프트웨어는 특허 및 저작권 등록을 획득하였다.
5.2 핵산/항체 기반 감염성 바이러스 진단기술 개발
감염성 바이러스 진단기술 개발을 위하여 대상 바이러스를 50종 선정하고, 프라이머 디자인 및 유전자 합성을 통하여 진단표준물질을 확보하였다. 핵산 기반 진단기술 개발을 위하여 실시간 유전자 추적 진단법(RT-PCR, 50종), 다중 동시감별 진단법(multiplex PCR, 7종), pan-marine virus 분자진단법(10종), 차세대염기서열 진단법(5종), 인수공통성 평가기법 구축(36건) 및 빅데이터를 이용한 메타게놈 분석(31건) 등 139건의 핵산 기반 진단법을 개발하였다. 개발된 진단법 중 RT-PCR 기반 진단법을 확립하기 위하여, 진단법의 반응 민감도 및 특이성을 분석하였으며, 11건의 진단키트 시제품을 제작하였다(Fig. 9A). 항체 기반 진단기술을 개발하기 위하여 8종의 바이러스를 대상 바이러스로 선정하였다. 선정된 바이러스의 외피단백질을 기반으로 항원을 선별하였으며, 유전자 합성을 통하여 항원 펩티드(24건)를 확보하였다. 항원 단백질에 대한 바이오패닝(biopanning)을 통하여 scFv 재조합 단백질을 선별(140건)하였으며, 반응 민감도 및 특이도 평가(24건)를 수행하였다. 선별된 scFv 단백질을 이용하여 효소결합면역흡착검사(enzyme-linked immunosorbent assay, ELISA) 기반 감염성 바이러스 진단키트 시제품을 8건 제작하였다(Fig. 9B).
5.3 감염성 바이러스 감염모델 개발
감염모델을 개발하기 위하여 1-2단계 연구 기간 동안 감염성 바이러스를 31종 확보하였고, 바이러스 감염이 가능한 세포주를 13주 확보하였다. Plaque assay와 RT-qPCR을 기반으로 18종의 바이러스에 대하여 감염 시험을 수행하였고, 1식의 in vitro 감염모델을 확립하였다(Fig. 10). 폐포오가노이드와 3D 스페로이드를 기반으로 오가노이드 기반 감염시험을 수행하였으며, 2식의 오가노이드 감염모델을 구축하였다.
5.4 항바이러스 전략 소재 발굴
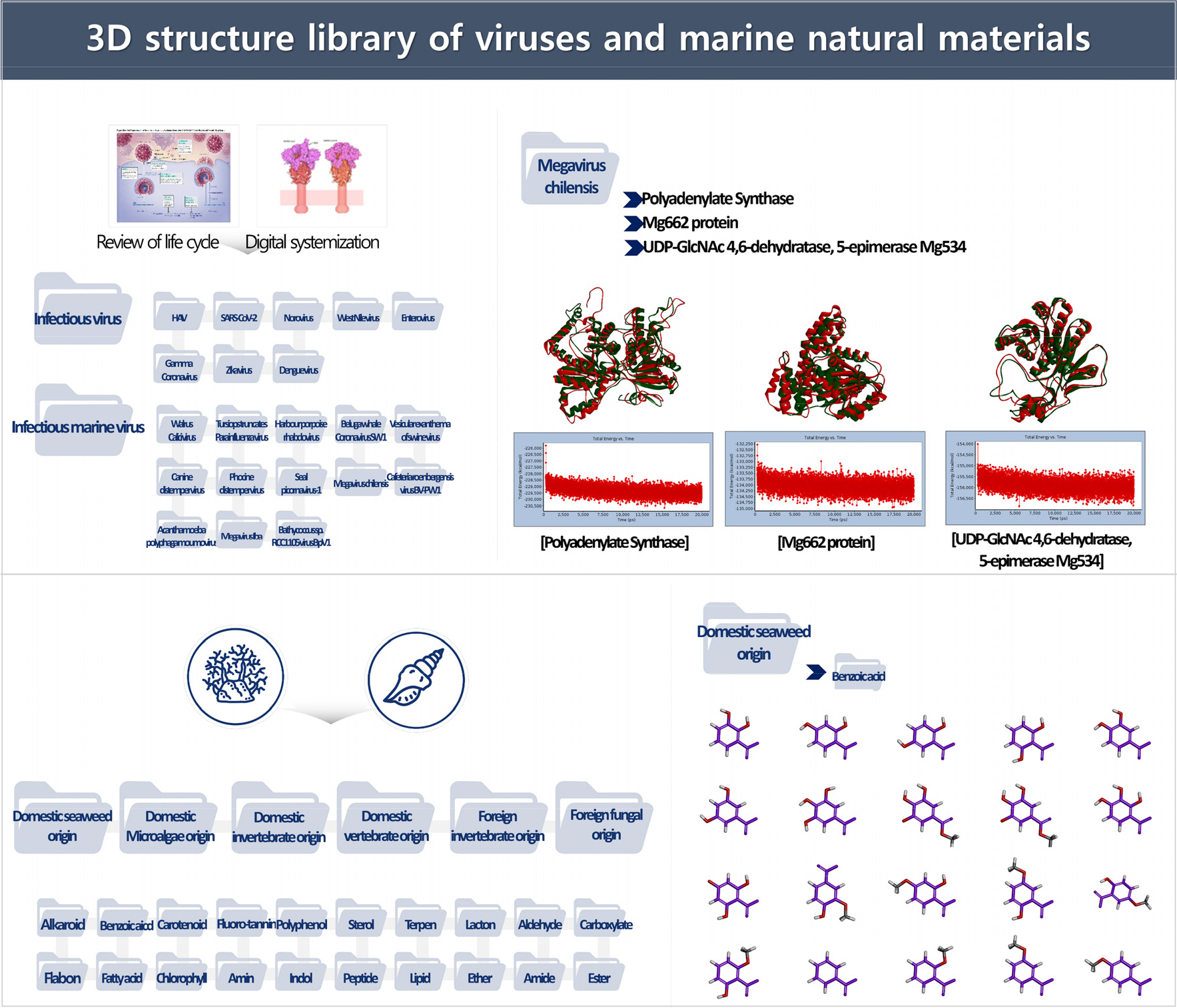
항바이러스 소재 발굴은 in silico 및 surrogate virus system을 기반으로 수행하였다. In silico 기반 항바이러스 소재 탐색을 위하여 감염성 바이러스(21종)와, 국내외 해양소재(551건)의 3D 구조를 확보하였다(Fig. 11). 이를 바탕으로 in silico 기반 항바이러스 해양소재 발굴을 위한 Drug Discovery Platform을 구축하였다(1식). 바이러스 단백질과 해양소재 3D 구조의 docking 분석을 수행하여 항바이러스 유효물질을 선별하고, 바이러스 감염 세포 모델에서 항바이러스 효능 및 작용기전을 분석함으로써 10건의 해양생물 유래 항바이러스 소재를 발굴하였다.
또한 항바이러스 소재 발굴을 위하여 대체바이러스 시스템을 구축하였다. 항 DNA 바이러스 소재 스크리닝을 위하여 클로렐라(Chlorella) 숙주와 직접 분리한 PKV2 (PuKyong chlorella Virus 2)를 응용하여 감염시스템을 구축하였으며, 항 RNA 바이러스 소재 스크리닝을 위하여 혈관내피전구세포(Endothelial Progenitor Cell, EPC)와 재조합 VHSV 바이러스 감염시스템을 구축하였다(Fig. 12). 구축된 대체바이러스 시스템을 이용하여 화합물(44,635건), 추출물(7,497건) 및 해양 우래 추출물(609건)에 대하여 항바이러스 스크리닝을 수행하였으며, 이를 통하여 22건의 항 DNA 바이러스 예비 후보물질 및 10건의 항 RNA 바이러스 예비 후보물질을 도출하였다(Table 1).
Table 1.
Derivation of preliminary anti-DNA and anti-RNA virus candidates based on surrogate visus system
5.5 광범위 항바이러스 치료제 개발
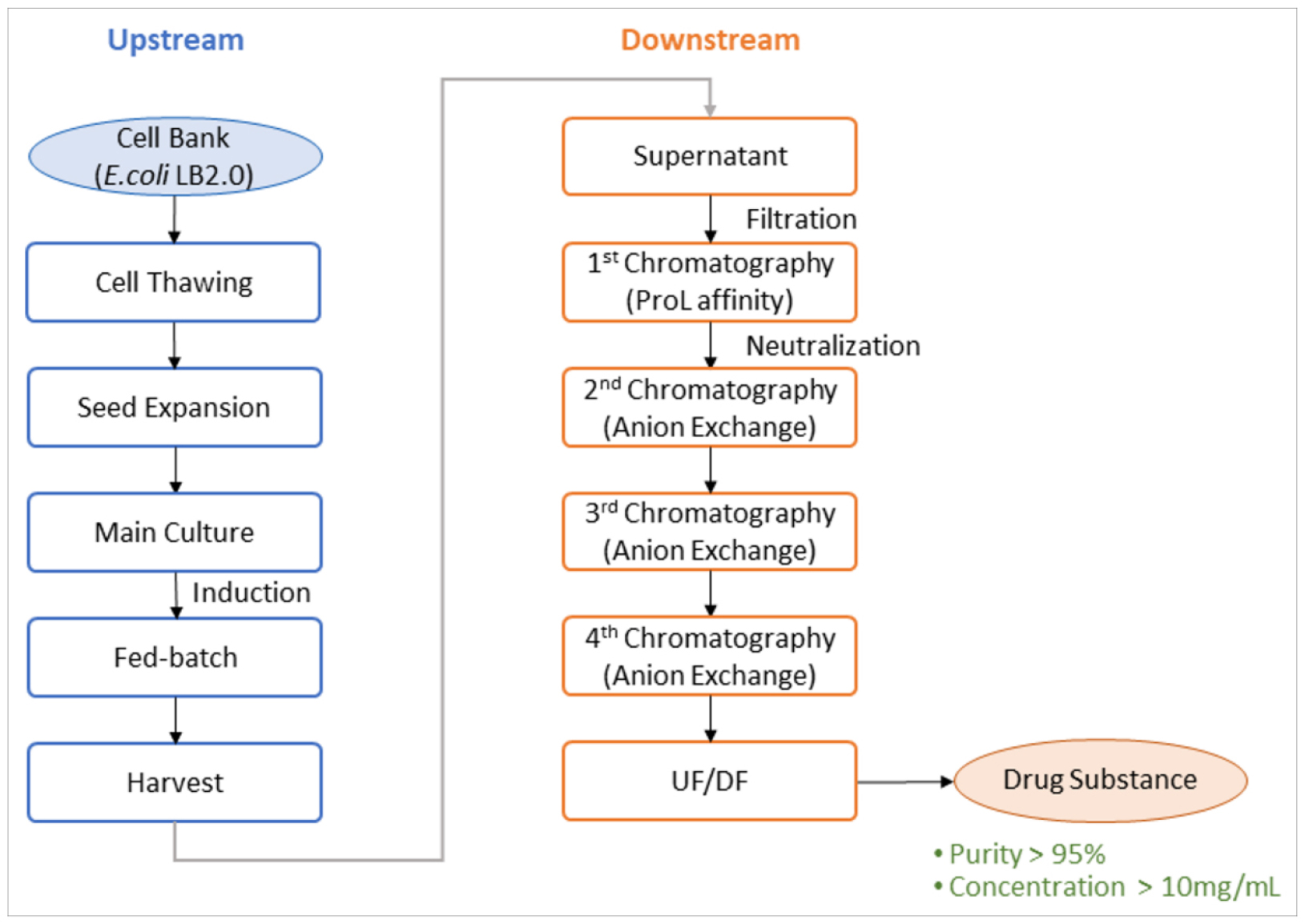
다양한 바이러스에 대한 항바이러스 효능이 확인된 3D8 scFv (single-chain variable fragment)를 기반으로 감염성 해양바이러스에 대한 광범위 항바이러스 치료제 개발을 수행하였다. 3D8 scFv에 대한 선도물질 최적화 작업을 통하여 안정적이고, 생산이 가능한 재조합 단백질 후보물질을 선정하였으며, 항바이러스 효능 분석을 통하여 새로운 scFv 단백질(NVG308)을 확보하였다. NVG308 생산 균주의 확보 및 발효공정 개발을 완료하였고, NVG308의 정제 및 분석공정을 확보하였다. 확보된 공정에 대한 최적화 및 스케일업 공정을 수행하여 파일럿 수준의 시험 생산을 완료하였다(Fig. 12). 대량 생산된 NVG308에 대한 in vitro 및 in vivo 항바이러스 활성시험을 실시하였으며, 재조합 단백질 scFv 기반 광범위 해양바이러스 감염 치료제 개발을 위한 치료제 소재를 확보하였다.
6. 연구개발 성과의 활용방안 및 전망
감염성 해양 바이러스는 해양 생태계와 인간 활동에 중대한 영향을 미치는 생물학적 인자로, 바이러스의 생태학적, 병리학적 역할에 대한 연구는 점차 중요성을 더하고 있다(Suttle, 2007). 빅데이터와 인공지능(Artificial intelligence, AI)을 활용한 연구는 해양 바이러스의 복잡한 생물학적 상호작용을 해석하고, 이를 기반으로 한 진단 및 치료 방법을 제시하는 데 중요한 도구가 되고 있다(Roux et al., 2016). 해양 바이러스 연구의 첫 단계는 유전체 및 생태적 데이터를 포함한 포괄적 빅데이터를 구축하는 것이다. 국제적으로는 Tara Oceans 프로젝트와 같은 대규모 이니셔티브가 메타바이롬 데이터베이스를 구축하며, 해양 바이러스의 유전적 및 생태적 다양성을 연구하고 있다(Gregory et al., 2019). 데이터마이닝 기법은 바이러스 군집의 구조, 기능, 숙주 범위 등을 분석하는 데 필수적이다. 특히 머신러닝과 딥러닝 알고리즘은 바이러스의 감염성을 예측하고, 숙주 간 전파 경로를 시뮬레이션하는 데 효과적으로 활용되고 있다(Rasmussen et al., 2022). 이러한 기술은 해양 바이러스 연구를 데이터 중심으로 전환하고 있으며, 환경 변화에 따른 바이러스 군집의 동적 변화를 실시간으로 분석할 수 있도록 지원한다.
메타게놈 분석과 환경 DNA (eDNA) 분석은 감염성 해양 바이러스의 조기 진단을 가능하게 한다. 특히, 초고속 시퀀싱 기술과 AI 기반 분석 플랫폼은 환경 샘플에서 병원성 바이러스를 신속히 검출하는 데 유용하다(Roux et al., 2016). 또한, CRISPR 기반 진단 기술은 특정 바이러스의 유전체를 신속하게 탐지할 수 있는 민감하고 정밀한 도구로 주목받고 있다(Koonin and Dolja, 2013). 이러한 기술은 해양 생물과 양식 산업의 질병 관리에 적용될 수 있으며, 조기 경보 시스템 구축에 기여할 것으로 기대되고 있다. 감염성 해양 바이러스의 병리학적 연구에서 감염 모델은 핵심적인 도구로 작용한다. 바이러스-숙주 상호작용을 이해하기 위해 in vitro 세포 배양 모델, 동물 모델, 그리고 컴퓨터 시뮬레이션 모델이 개발되고 있다(Wu et al., 2024). 컴퓨터 기반 감염 모델은 바이러스 전파와 숙주 반응을 예측하는 데 강력한 도구로 활용되며, 특히 메타바이롬 데이터를 활용하여 바이러스의 감염성 동역학을 시뮬레이션할 수 있다(Rasmussen et al., 2022). 또한 이러한 모델은 해양 환경에서 감염성 질병의 전파를 억제하는 데 유용한 정보를 제공한다. 해양 바이러스 감염을 제어하기 위해 항바이러스 소재와 치료제 개발 연구가 활발히 진행되고 있다. 해양 미생물, 해조류 및 해양생물에서 유래한 천연 화합물은 항바이러스 소재로 유망하며, 현재 여러 연구에서 항바이러스 활성을 검증하고 있다(Liang et al., 2019; Volpe et al., 2023). CRISPR-Cas9 기반 유전자 편집 기술은 특정 바이러스를 표적화하여 제어하는 데 강력한 도구로 사용될 수 있다(Koonin and Dolja, 2013). 또한, AI와 데이터마이닝 기술을 통해 화합물 데이터베이스와 바이러스 표적 데이터를 분석하여 신약 개발 과정을 가속화할 수 있다.
감염성 해양 바이러스 연구는 빅데이터 구축, 데이터 마이닝, 진단 기술, 감염 모델, 항바이러스 소재 및 치료제 개발을 아우르는 통합적 접근을 통해 큰 도약을 이루고 있다. 이러한 연구는 해양 생태계의 건강을 유지하고 인간 활동에 미치는 영향을 최소화하는 데 기여할 것이다. 향후에는 국제적 데이터 공유와 협력을 통해 빅데이터의 가치를 극대화하고, 인공지능 및 유전자 편집 기술을 활용한 맞춤형 진단 및 치료제가 개발될 것으로 기대되고 있다(Gregory et al., 2019; Liang et al., 2019). 이러한 발전은 해양 바이러스의 생태학적 역할과 병리학적 영향을 심층적으로 이해하는 데 중요한 기여를 할 것으로 기대된다.