1. 서 론
2. 섬모충플랑크톤 종동정
3. 섬모충플랑크톤 분자생물학적 정보
4. 섬모충플랑크톤 정량분석
5. 섬모충플랑크톤 서식환경 정보
6. 섬모충플랑크톤 모니터링 방법
6.1 시료채집 및 전처리
6.2 현미경 관찰
6.3 형태적 특징
6.4 개체수 산정
6.5 유전자 분석
6.6 분석기술의 고급화
1. 서 론
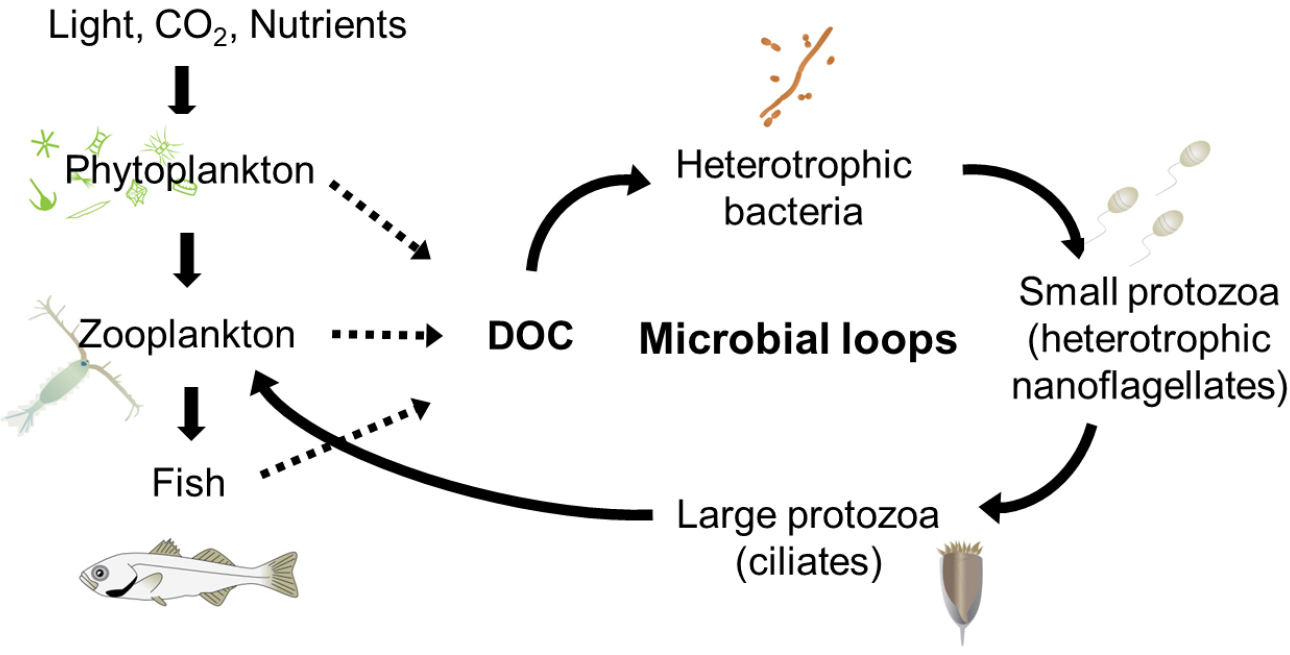
해양 수서생태계에서 소형동물플랑크톤(microzooplankton)은 요각류(copepoda)와 같은 동물플랑크톤의 먹이생물로서, 동시에 미소플랑크톤(nanoplankton)의 포식자로서 즉, 두 그룹의 사이에서 효율적으로 에너지를 전달해 주는 매개자 역할을 담당하고 있다. 특히, 소형동물플랑크톤의 대부분을 차지하고 있는 섬모충플랑크톤(ciliateplankton)은 미소플랑크톤 뿐 아니라 박테리아와 같은 초미소플랑크톤(picoplankton)을 주로 섭식하며, 미세먹이망(microbial food webs)의 최종 소비자로써 고차생산단계로의 에너지 전달자로 알려져 있다(Fig. 1). 최근 보고에 따르면 지구 온난화에 따라 해양생물의 크기가 작아지며 플랑크톤의 크기도 소형(micro)에서 미소(nano)와 초미소(pico)로의 변화가 언급된바 있으며(Sheridan and Bickford, 2011; Peter and Sommer, 2013), 수온의 상승에 따라 수온약층의 발달로 영양염의 공급이 제한되어 부유생태계 내에서 에너지의 흐름은 기존의 섭식먹이사슬(grazing food chain)보다 미세먹이망으로 전달되는 에너지 흐름이 강조되고 있다(Lewandowska et al., 2014). 따라서 기후변화의 시대에 해양에서 섬모충플랑크톤의 역할은 더욱 중요하다고 할 수 있다.
해양 섬모충플랑크톤의 분류학적 연구는 비교적 종 동정이 용이한 분류군인 유종섬모류(tintinnids)가 먼저 활발하게 수행되었다. 유종섬모류의 분류 기준인 피갑(lorica)의 형태가 가변성이 있어 문제점이 제시되기도 하지만, 현재까지 피갑의 형태적 특징을 기재한 대표적 문헌으로 동적도태평양 탐사의 유종섬모류 단행본(Kofoid and Campbell, 1929, 1939)이 종의 분류에 널리 참고 되어 왔다. 또한 1930년대 일본 연안과 서적도태평양에서 다양한 유종섬모류의 종 소개(Hada, 1932a, 1932b, 1935, 1937, 1938)도 우리나라의 인접해역에서 분류학적 연구에 유익하게 활용되었다.
한편, 연약한 세포로 형태분석이 어려운 소모류(oligotrichs)의 분류학적 연구는 1980년대 후반에 들어서 주로 북미권의 연구자들이 세포 염색법을 통해 섬모배열을 관찰하여, 해양에 분포하는 종들의 형태기재 및 신종보고와 함께 분류체계를 정리하여 발표하였다(Lynn and Montagnes, 1988; Lynn et al., 1988; Montagnes and Lynn, 1991; Montagnes et al., 1988). 이후, 이들 문헌을 통한 분류학적 정보를 근거로, 소모류에 속하는 많은 종들이 세계 각처의 해역에서 신종으로 보고되었다. 연구방법론의 보완과 수정을 거듭하면서 신종이 꾸준히 보고되고 있어 종다양성 정보가 지속적으로 축적되고 있다. 유전자 정보에 의한 계통분석의 결과를 바탕으로 형태적 특징으로는 분류가 어려웠던 근연종(sibling species)의 분류도 보다 용이하게 시도되고 있다.
세계 각처 해역에서 해양 섬모충플랑크톤 도감(Alder, 1999; Chihara and Murano, 1997; Xu et al., 2009)과 분류학적 연구의 단행본(Kofoid and Campbell, 1929, 1939; Hada, 1937, 1938)이 출판되어 관련 연구자들에게 유용한 정보를 제공함과 동시에, 기존의 식물과 동물로만 이분된 플랑크톤 연구는, Azam et al.(1983)이 소형플랑크톤의 역할을 강조한 이후, 섬모충플랑크톤까지 포함하여 부유생태계 연구방향이 전환되었으며 섬모충플랑크톤의 분류생태학적 연구는 필수적인 영역이 되었다. 국내에서는 1980년 후반부터 유 등(Yoo et al, 1988; Yoo and Kim, 1990)에 의해 시작된 해양 섬모충플랑크톤의 분류학적 연구가 2000년대 이후 생태, 생리학적 연구로 심화되고 있으나(Jeong et al., 2004; Kim et al., 2007, 2012), 타 플랑크톤 분류군에 비해 시료 분석과정의 어려움은 관련 전문가 저변 확대의 걸림돌이 되고 있다.
최근 섬모충의 형태적, 분자적, 생태적 분석을 통한 종동정의 기술을 정리한 총설이 보고되었다(Abraham et al., 2019). 해양이라는 수권 공간의 접근성은 육상보다 어렵기 때문에, 해양에서 섬모충플랑크톤의 국내 연구의 접근 수월성을 확보하려면 이상적인 연구방법과 현실적인 접근한계 사이에서 어느 정도를 수용할 것인가에 대한 고민이 필요하다. 따라서 본 논문을 통해 국내에서 섬모충플랑크톤의 현장 조사와 자료의 정도관리를 위한 연구방법과 범위를 제안하여 섬모충플랑크톤 수용 가능한 연구방향을 세우고자 한다.
2. 섬모충플랑크톤 종동정
섬모충플랑크톤의 대표적 분류군인 유종섬모류는 피갑의 형태적 특징을 근거로 오랫동안 종을 동정해왔다. 그러나 피갑은 원충을 담고 있는 외부 구조물임으로 서식 환경에 따라 변화하여, 종동정이 어려운 원인이 되기도 했다. 피갑의 구경 크기는 비교적 변화가 적어 타 형질에 비해 안정된 형질로 언급되고 있지만(Dolan, 2010), 실제 종동정시에는 피갑의 전체 형태를 관찰하여 주요 특징을 파악한 후, 형태적 변이 여부 또한 숙고하여 동정에 임해야 한다. 광온성 종의 경우는 수온이 점진적으로 상승 또는 하강에 따라, 형태 변이도 점진적으로 발생하게 된다. 시계열로 채집된 시료 속에 종의 개체수가 충분한 경우, 피갑의 형태적 변이를 추적하여 해석이 가능하지만, 간헐적으로 출현하는 개체의 형태 변이는 다른 종으로 오인하기 쉽다. 따라서 최근에는 피갑 형태뿐 아니라, 피갑 내부에 원충의 섬모 배열까지 관찰하는 정밀한 분석이 종동정의 방법으로 도입되고 있다(Santoferrara et al., 2016). 섬모의 배열을 관찰하기 위해서는 프로타골 염색법(protargol staining)의 일종인 윌버트 방법(Wilbert, 1975)을 통해 세포를 염색한 후, 복잡한 섬모의 배열을 비교 검토해야 하는 어려움이 뒤 따른다. 따라서 아직까지 유종섬모류의 원충 섬모열 정보는 보편화 되어 있지는 않으나, 신종의 발표 시에는 필수적으로 정보제공이 요구되고 있다. 최근에 섬모열 정보를 포함하는 종의 재기재 논문들이 지속적으로 출간되고 있어 유종섬모류 종분석도 정밀화 시대를 맞이하고 있다(Agatha and Riedel-Lorhe, 2006; Agatha, 2010; Kim et al., 2010; Bai et al., 2020a, 2020b).
유종섬모류와 함께 대표적인 해양 부유성 섬모류의 분류군은 소모류(oligotrich ciliates)로 피갑이 없이 그대로 원충이 외부환경에 노출되어 있어, 일명 무각 섬모류(naked ciliates 또는 aloricated ciliates)라 불리기도 한다. 소모류는 섬모의 배열을 반드시 관찰해야 종동정이 가능한 까다로운 분류군이다. 세포염색 없이 현미경의 형태적 관찰만으로 종을 기재한 오래된 문헌들은 고정 상태에 따른 형태변화가 심하고, 섬모의 정확한 관찰 기재가 없어, 종동정의 정보로 신뢰하기 어려웠다. 소모류는 프로타골 염색을 통해 섬모열을 정밀 관찰하고 분석하여 출현종의 정보를 얻을 수 있다. 1980년대 북미권 학자들의 소모류 기재를 발판으로, 소모류 섬모열 정보가 축적되기 시작하였고, 2010년 이후, 유럽과 중국의 학자들에 의해 소모류 섬모배열에 관한 정보와 유전자 정보를 종합하여 소모류의 분류체계는 진화적 해석과 함께 새롭게 제시되었다. 기존의 속(genus)으로부터 일부 종들을 신속으로 분리시키는 등, 분류체계가 보다 다양하게 분지되었다(Agatha and Strüder-Kypke, 2014; Liu et al., 2015). 이렇게 복잡하게 바뀐 속의 분류는 섬모열의 특징을 정확히 파악해야 가능함으로 프로타골 염색은 섬모충 연구자들에게는 필수적 분석기술이라 할 수 있다.
프로타골 염색기술은 은단백질화합물(silver proteinate)이라는 시약이 섬모충 세포내의 핵산과 아미노산과 결합하여 염색되는 원리로, 세포의 핵과 동시에 단백질로 되어 있는 섬모의 구조가 염색되어 현미경으로 관찰이 가능하며, 유럽의 분류학자들이 오래 전부터 사용한 방법이다(Wilbert, 1975). 은단백질화합물는 여러 제조사에서 시판 되었으나 최근에는 더 이상 제조 시판되지 않아 연구자가 직접 만들어 쓰는 방법이 소개되었다(Pan et al., 2013; Kim and Jung, 2017). 그러나 소개된 방법에 의거하여 직접 제조한 시약을 사용한 경우, 염색효과가 저하되어 특히, 소모류와 같이 세포가 작고 섬모가 연약한 경우는, 섬모열 분석에 어려움을 겪고 있는 실정이다. 은단백질화합물을 사용하지 않고 섬모열과 핵을 염색할 수 있는 은탄산염(silver carbonate) 염색법은 섬모충플랑크톤의 주요 분류군인 소모류와 유종섬모류의 경우, 종에 따라 염색이 어려운 경우가 있고 더불어 영구표본을 제작할 수 없어서 단점이 있다(Foissner, 2014). 따라서 염색효과의 향상을 위한 기술개발은향후 섬모충플랑크톤 연구자들이 반드시 해결해야 할 과제로 남아있다.
3. 섬모충플랑크톤 분자생물학적 정보
섬모류는 비교적 형태적 변이가 큰 단세포 생물군으로, 현미경 관찰을 통한 형태적 특징으로만 종동정이 불가능한 경우가 빈번하고, 새로운 종을 보고 할 경우에는 종에 대한 정밀정보는 필수적으로 제공되어야 신종으로 수용될 수 있다. 분자생물학적 정보의 제공은 종에 대한 신뢰도를 높일 수 있는 유력한 방법이다. 가장 보편적인 분자생물학적 자료는 18S ribosomal DNA (rDNA) 유전자 정보이며, 형태적 종동정의 결과를 확증하는데 유용한 정보로 알려져 있다. 최근에는 ITS (internal transcribed spacer)와 28S (large subunit rDNA)와 같은 보다 넓은 범위의 유전자를 동시에 분석하여 형태로는 구분이 어려운 근연종 간의 유전자 차이를 분석하고 있다(Xu et al., 2012; Kim et al., 2020). 최근 들어 리보좀 유전자로는 근연종의 종식별에 한계가 있어, 미토콘드리아 CO1 유전자를 활용한 연구가 수행되고 있다(Jung et al., 2018; Park et al., 2019). 섬모충플랑크톤 종들의 유전자 정보는 유전자 은행(NCBI gene bank)에 등록되어 연구자들이 종동정과 계통분석을 위해 매우 유익한 정보인프라로 공유되고 있다.
섬모충플랑크톤의 종에 대한 유전자정보를 공유하여 활용할 경우, 형태적 종동정이 잘못된 상태에서 오동정된 종명으로 유전자가 등록되면 심각한 문제를 발생시키게 된다. 따라서 유전자 정보는 반드시 형태정보를 동시에 제공하여 형태 동정의 수용을 전제로 유전정보는 비교 분석되어야 한다.
4. 섬모충플랑크톤 정량분석
유종섬모류의 경우는 피갑의 형태로 종을 동정할 수 있어서, 현미경 관찰로 종동정과 종의 계수를 동시에 할 수 있다. 단, 피갑 속에 원충이 들어있지 않는 빈 피갑은 계수하지 않는 것이 바람직하다. 실제 수중에 살아있었지만 고정액 처리와 기타 채집 시, 물리적 요인에 의해 원충이 피갑에서 탈피하는 경우가 발생한다. 이렇게 채집 과정 시, 파생된 빈 피갑과 이미 사멸하여 수중에 피갑만 남은 상태와 구분 할 수 없기 때문에, 빈 피갑의 경우는 개체수에 포함시키지 않는 것이 바람직하다. 피갑 속의 원충이 사멸 한 후에도, 피갑은 오랫동안 수중에 잔존할 수 있음으로, 빈 피갑을 계수하면 섬모충 현존량의 실측값과는 차이를 보일 수 있기 때문이다.
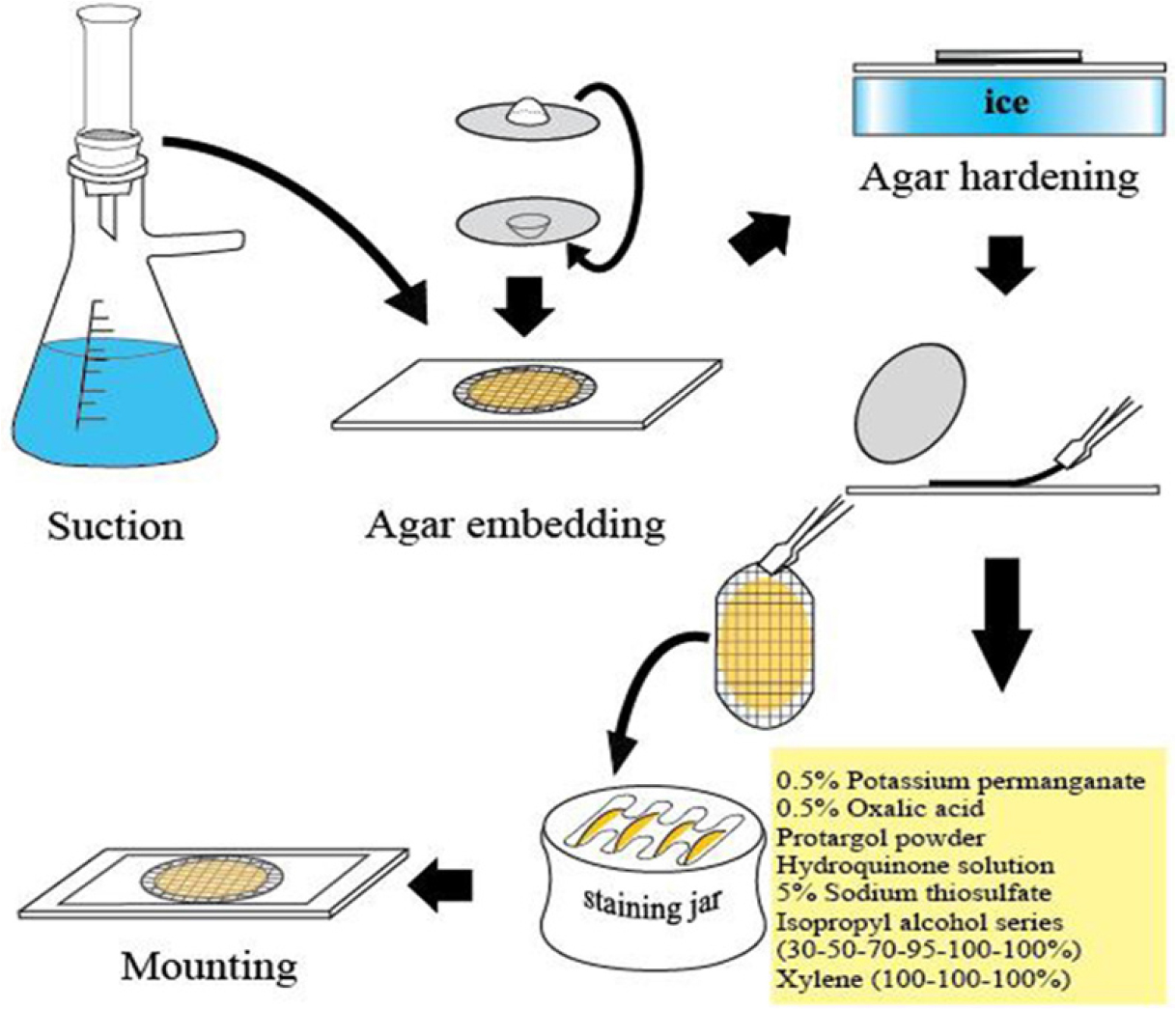
Laboea strobila와 같이 일부 종은 형태적 특징이 뚜렷하여, 염색하지 않는 고정된 시료의 현미경 관찰로도 계수가 가능한 예외적인 경우를 제외하고, 소모류의 정량분석은 정량 프로타골 염색법 [Quantitative Protargol Staining (QPS)]에 의해서만 가능하다(Montagnes and Lynn, 1987). 채집된 해수의 정해진 양을 여과한 후, 프로타골 염색과정을 거치고, 여과지 위에 염색된 세포를 현미경 관찰을 통해 종을 동정하면서 동시에 계수도 할 수 있다(Fig. 2). 그러나 현재 은단백질화합물의 시판이 중지된 상태임으로, 직접 연구자가 제조한 시약으로 정성분석을 위한 윌버트 방법의 염색효과가 어느 정도 나타나지만, 세포 계수를 위한 QPS 방법을 적용할 경우는 염색이 잘 되지 않아서 현실적으로 종수준의 정량분석은 어려운 실정이다.
종수준의 계수는 불가능하지만, 종의 구분 없이 세포의 크기별(< 20 μm, 20-50 μm, 50-100 μm, > 100 μm)로 소모류 그룹을 나누어 정량 분석한 결과로 각 크기그룹의 개체수와 유효한 먹이생물과의 관계를 해석할 수 있다(Kim et al., 2021). 그러나 종수준의 개체수 분석은 섬모충플랑크톤의 생태학적 연구의 필수적 정보임으로 앞으로 연구자들이 해결해야 할 문제이다.
섬모충플랑크톤의 정량적 자료는 개체수(cells L-1)로 보통 표현하지만, 때에 따라서 탄소생체량(μg C L-1)으로 환산하여 나타내기도 한다. 개체수의 정량결과는 세포의 크기가 고려되지 않는 단점이 있어, 생태 및 생리학적 연구목적에 따라 탄소생체량을 사용하기도 한다. 소모류의 탄소생체량은 세포의 기하학적 구조를 고려하여 길이와 넓이의 크기를 측정하여 체적(μm3)을 구한 후, 탄소생체량 전환율 0.19 pg μm−3(Putt and Stoecker, 1989)을 적용하여 환산한다. 유종섬모류의 경우는 피갑의 체적을 구한 후, 전환식 carbon (pg)=444.5+0.053 lorica volume (μm3)에 의해 탄소생체량을 계산하고 있다(Verity and Langdon, 1984).
5. 섬모충플랑크톤 서식환경 정보
지구온난화에 따른 해양생태계의 변화에 대한 연구를 위해 수온의 변화에 민감한 해양생물의 종류는 중요한 연구 대상 생물이 될 수 있다. 섬모충플랑크톤 중에 유종섬모류는 수온의 변화에 민감한 종들이 많이 포함되어 있으며, 이런 종들의 출현은 뚜렷한 지리분포를 나타냄으로 일명 “생물학적 지문(fingerprint)”으로 언급되기도 하였다(Modigh et al., 2003). 특히, 서로 다른 해류가 만나는 수역에서 해류의 동태를 파악하기 위해 생물학적 지표생물(biological indicator)의 분포 자료로 유종섬모충의 종분포 특성을 이용하기도 하였다(Kato and Taniguchi, 1993).
따라서 조사수역의 수환경요인 정보는 섬모충플랑크톤 종 출현의 시공간분포 변화를 해석하기 위해 중요한 기초자료가 된다. 한반도 해역은 남쪽 외해로 부터 쿠로시오와 북쪽의 동한 한류와 더불어 중국 연안수의 북상과 같은 해류의 영향 해석 시에, 수온과 염분의 자료를 필수적으로 확보되어야 한다. 더불어 섬모충플랑크톤의 대부분의 종류는 종속영양성으로 먹이생물의 분포는 섬모충플랑크톤의 분포에 큰 영향을 줄 수 있다. 섬모충플랑크톤 세포 구경크기를 고려하면 먹이생물로 초미소와 미소플랑크톤과 같은 작은 플랑크톤 생물량은 섬모류 분포와 밀접한 관계를 보임이 여러 연구 사례를 통해 보고되어 있다(Pierce and Turner, 1992). 따라서 엽록소의 크기별 분획 자료와 박테리아, 종속영양미소편모조류 등의 생물량은 수온과 염분과 더불어 중요한 서식 환경정보라 할 수 있다.
6. 섬모충플랑크톤 모니터링 방법
섬모충플랑크톤의 정량 및 정성 분석을 위한 방법론은 현시점 수용 가능한 범위를 고려하여 다음과 같이 제안하고자 한다.
섬모충플랑크톤의 정량 및 정성 분석을 위한 방법론은 현시점 수용 가능한 범위를 고려하여 다음과 같이 제안하고자 한다.
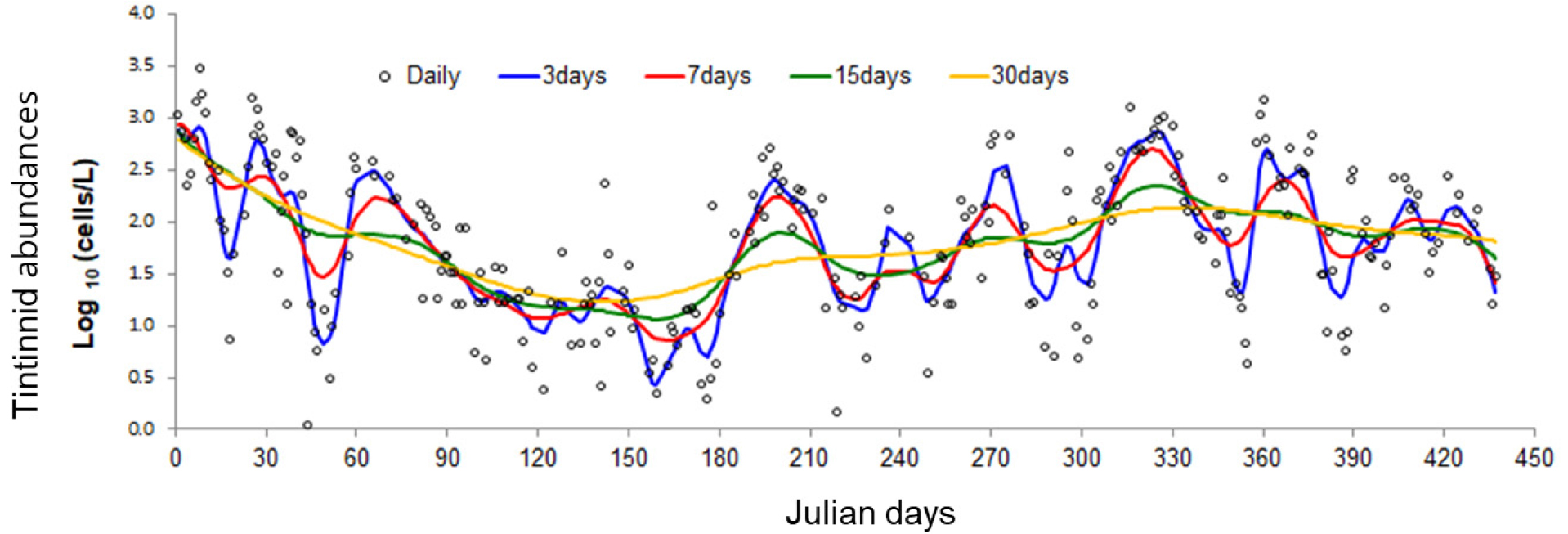
섬모충플랑크톤은 단세포 진핵생물로, 일반적 단세포 생물은 증식 속도가 빨라 개체군의 증감이 단시간 내에 빠르게 변동한다(Kamiyama and Tsujino, 1996; Modigh and Castaldo, 2002). 과거 유종섬모류의 생태학적 연구의 대부분은 한 달에 한 번의 채집주기가 가장 빈번하였다(Feng et al., 2018). 월별 시료채집으로 섬모충 개체군 변화를 분석할 경우, 섬모충의 빠른 증식을 고려한 개체군의 빠른 변동을 감지하지 못하고 누락될 가능성이 높다. 유종섬모류 개체수를 매일 모니터링한 결과, 개체수의 증감이 반영되는 채집주기는 주별의 조사주기 정도가 개체군 변동을 확인할 수 있다(Fig. 3). 빈번한 현장조사의 어려움을 고려하여, 적어도 2주에 한 번씩의 주기로 모니터링을 하여야 계절변화와 같은 시계열 분석이 가능하리라 판단된다.
정량분석용 시료는 Van-Dorn 채수기를 사용하여 1-2 L를 채수하여, 중성루골용액을 최종농도 2%가 되도록 고정한다. 이 때 농도를 계산하여 고정액을 플라스틱 채집병에 미리 넣어 놓은 후, 채수된 시료를 천천히 주입하여 고정 시에 유발되는 섬모충 세포의 손상을 줄인다. 중성루골액으로 고정하는 장점은 고정액에 의한 세포의 수축이 비교적 적고, 종동정시 개체를 분리하여 유전자 분석을 실시 할 수 있다.
고정시료는 실내에서 24시간 침전시킨 후, 상등액은 버리고 가라앉은 침전물을 5-50 ml로 농축하여 검경시료로 사용한다. 일정한 농축비율을 정하여 시료를 분석하여 상대적 시계열 자료 비교 시 농축비율에 의한 오차가 생기지 않도록 한다.
정성분석용 시료는 플랑크톤 네트(망목크기 20 μm)을 이용하여 수심 5 m에서 수직으로 천천히 끌어 올려 채집한 후, 정량분석과 동일하게 중성 루골로 시료를 고정한다. 루골로 고정된 시료는 냉암소에 보관함이 원칙이다.
소모류의 경우, 해수를 채수하여, 세포의 고정을 위해 Bouin 용액이 최종농도가 10%, 아세트산이 최종농도 1%가 되도록 각각 미리 넣어둔 플라스틱 채집병(300 ml 용기)에 해수를 적정량 넣는다(Montagnes and Lynn, 1987). 즉, 세포의 신속한 고정을 위해 채집병에 고정액을 먼저 넣은 후, 채집된 해수를 나중에 주입함을 권장한다. Bouin 용액으로 고정된 시료는 상온에서도 오랜 기간(수년간) 보존되어 지속적인 활용이 가능하다.
유종섬모류와 소모류 모두, 신종의 보고 시에는 반드시 살아 있는 개체의 형태 정보도 제공해야 함으로, 이 경우는 네트로 채집 후, 해수를 고정하지 않고 채집병에 채우고 자연의 해수 온도와 유사하게 유지하여 신속하게 실험실로 운반하여 생시료를 분석한다.
6.2 현미경 관찰
유종섬모류의 경우는 다음과 같이 종동정과 세포의 계수를 동시에 할 수 있다. 농축된 고정시료를 1 mL을 스포이드로 취하여, 계수판(Sedgewick Rafter Counting Chamber) 위에 올려놓은 후, 커버글라스를 덮은 후 광학현미경으로 관찰한다. Sedgwick Rafter 계수판은 현미경 200 (10 × 20)배 까지 검경이 가능함으로 대부분의 종은 동정과 계수가 동시에 가능하다. 세포의 크기가 작아 고배율로 세밀한 형태적 특징을 관찰하기 위해서는 슬라이드 글라스 위에 시료를 스포이드로 몇 방울 떨어뜨린 후, 커버글라스를 덮고 광학현미경으로 고배율(400-1000배)하에서 형태적 정밀 관찰을 별도로 추가하여 할 수 있다.
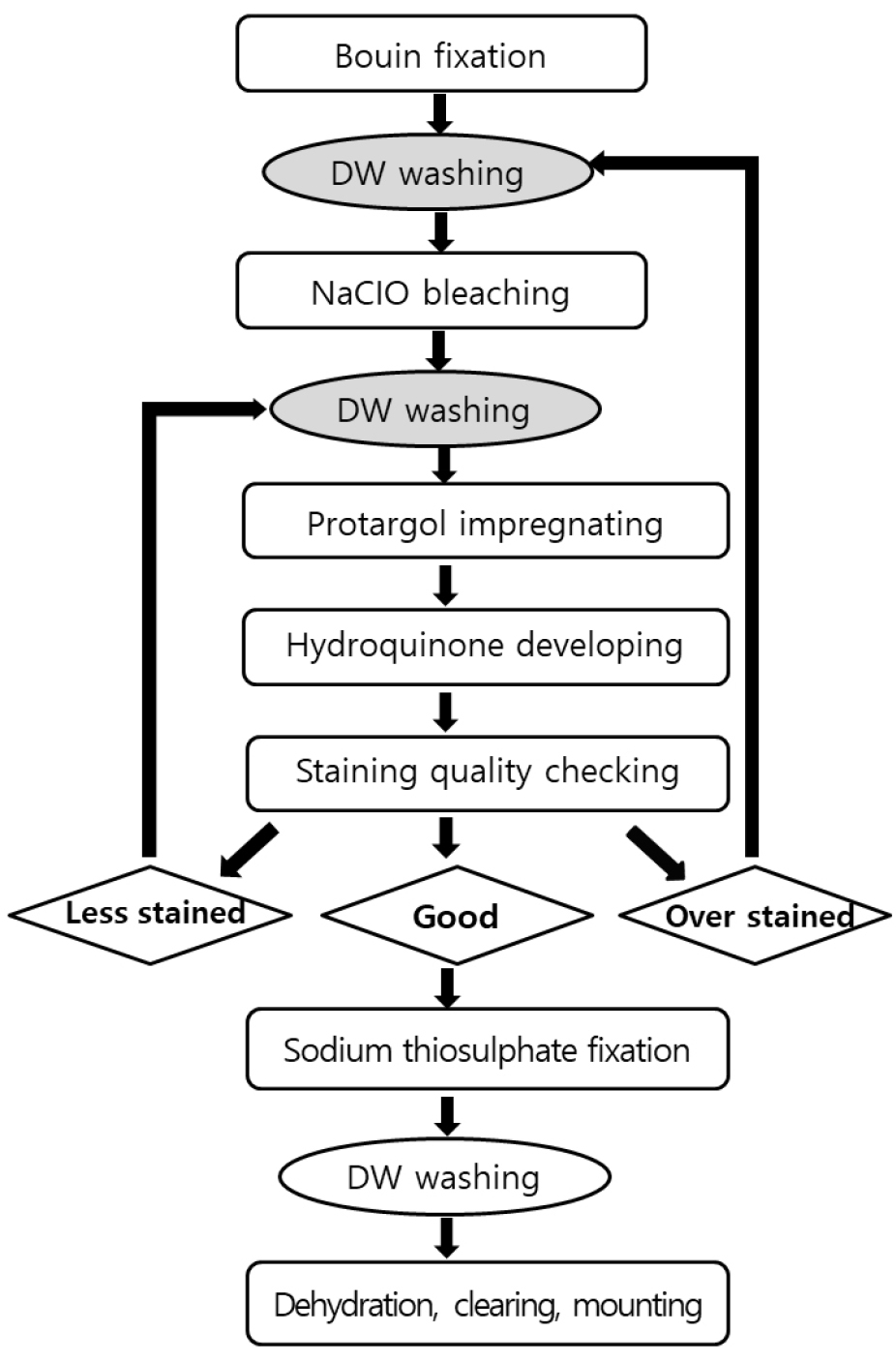
소모류의 경우는 종의 동정을 위해서는 생체관찰과 염색표본관찰의 두 가지 관찰법을 병행하여야 한다. 생체관찰의 경우 섬모충을 마이크로 피펫으로 뽑아 슬라이드 글라스에 두고 커버글라스를 덮은 다음 광학현미경을 통해 관찰한다. 살아있는 섬모충은 빠르게 움직이기에 즉시 관찰은 어려우나 움직임이 둔해질 때까지 기다린 후 관찰함이 바람직하다. 소모충의 경우 종동정을 위해서는 섬모를 프로타골 염색법을 통하여 염색하여 그 수와 배열을 관찰해야 한다. 종동정 만을 위한 정성분석의 경우는 윌버트 방법을 개선한 염색법이 Ji and Wang(2018)에 의해 소개되어 섬모와 핵을 염색하여 종을 동정할 수 있다(Fig. 4). 정량용 프로타골 염색(QPS)을 통해 종동정과 계수를 동시에 할 수 있다. QPS 방법으로 영구슬라이드표본을 제작한 후 광학현미경으로 종동정과 계수를 동시에 실시한다. QPS 영구표본은 고배율(400-1000배)의 관찰도 용이하고, 표본은 형태의 손상 없이 영구적으로 보관할 수 있어 시료의 재검경이 가능한 큰 장점을 가지고 있다(Fig. 2). 그러나, QPS의 경우, 윌버트 방법과 달리, Pan et al.(2013)의 제조법에 따라 만든 은단백질화합물은 염색효과가 저하되어 현재 연구자들이 QPS 시료 분석에 어려움을 겪고 있다.
6.3 형태적 특징
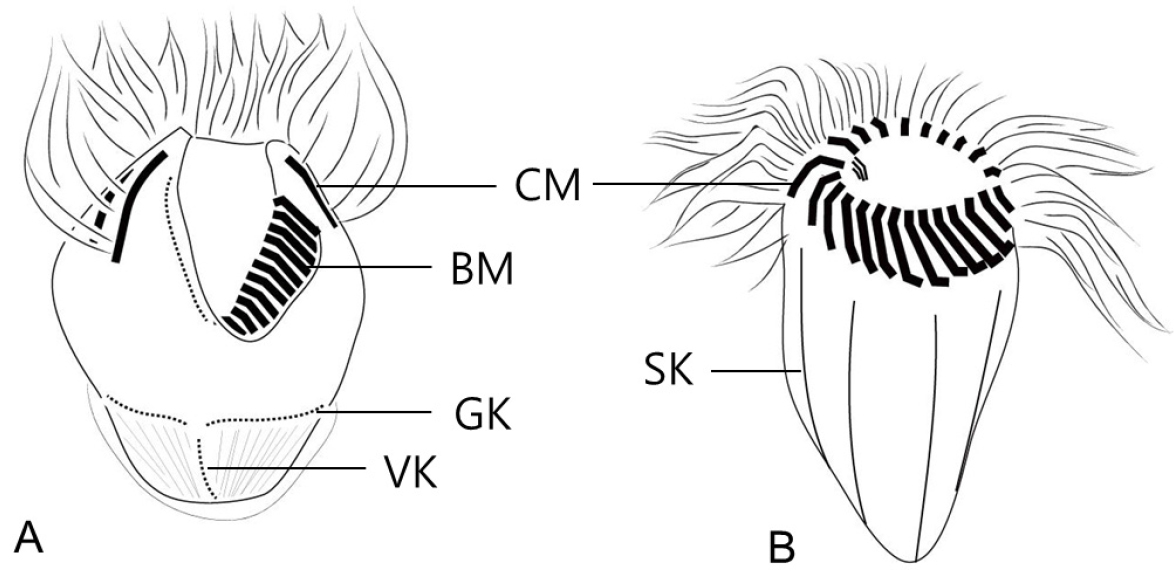
유종섬모류 피갑의 형태는 크게 두 그룹, 이물질 부착형(agglutinated lorica)과 투명막형(hyaline lorica)으로 구분한다(Fig. 5). 이물질 부착형은 이물질 부착의 범위가 피갑 전체 또는 일부에 따라 세분되며, 피갑의 구부와 반구부의 형태와 피갑 표면의 무늬와 미세 구조에 따라 종을 구분한다. 특히 경부(피갑의 상부)의 다양한 형태 변화는 종동정의 주요 특징이 되고 있다.
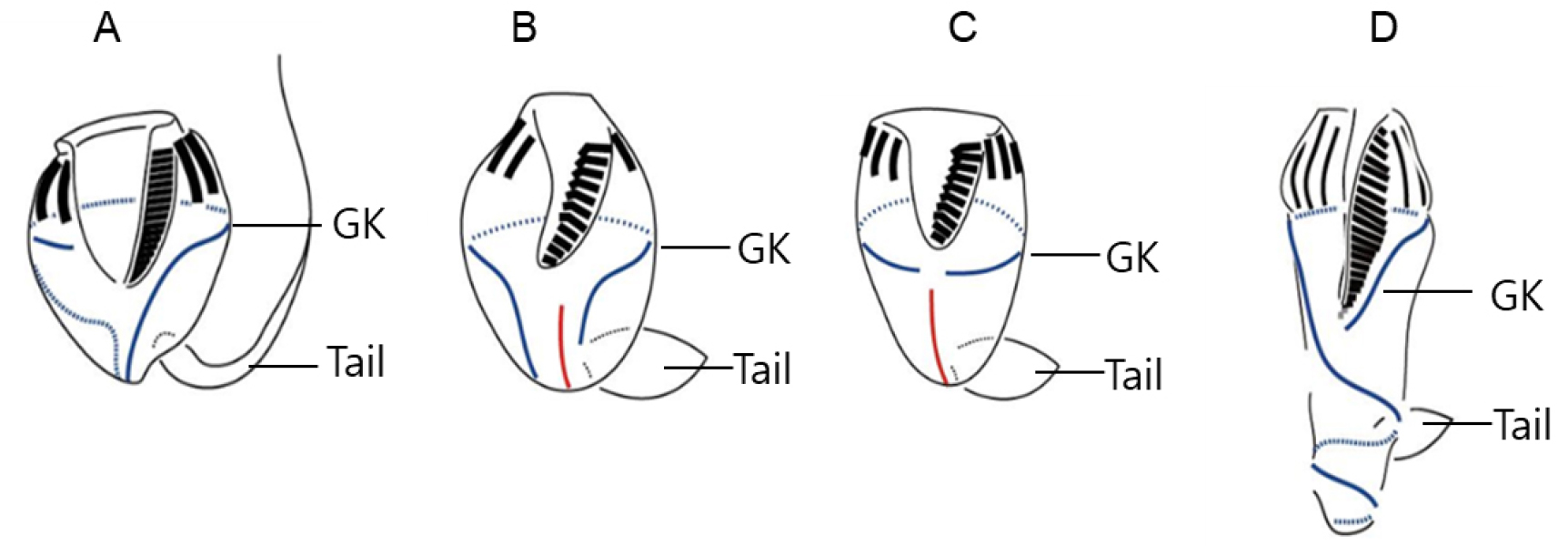
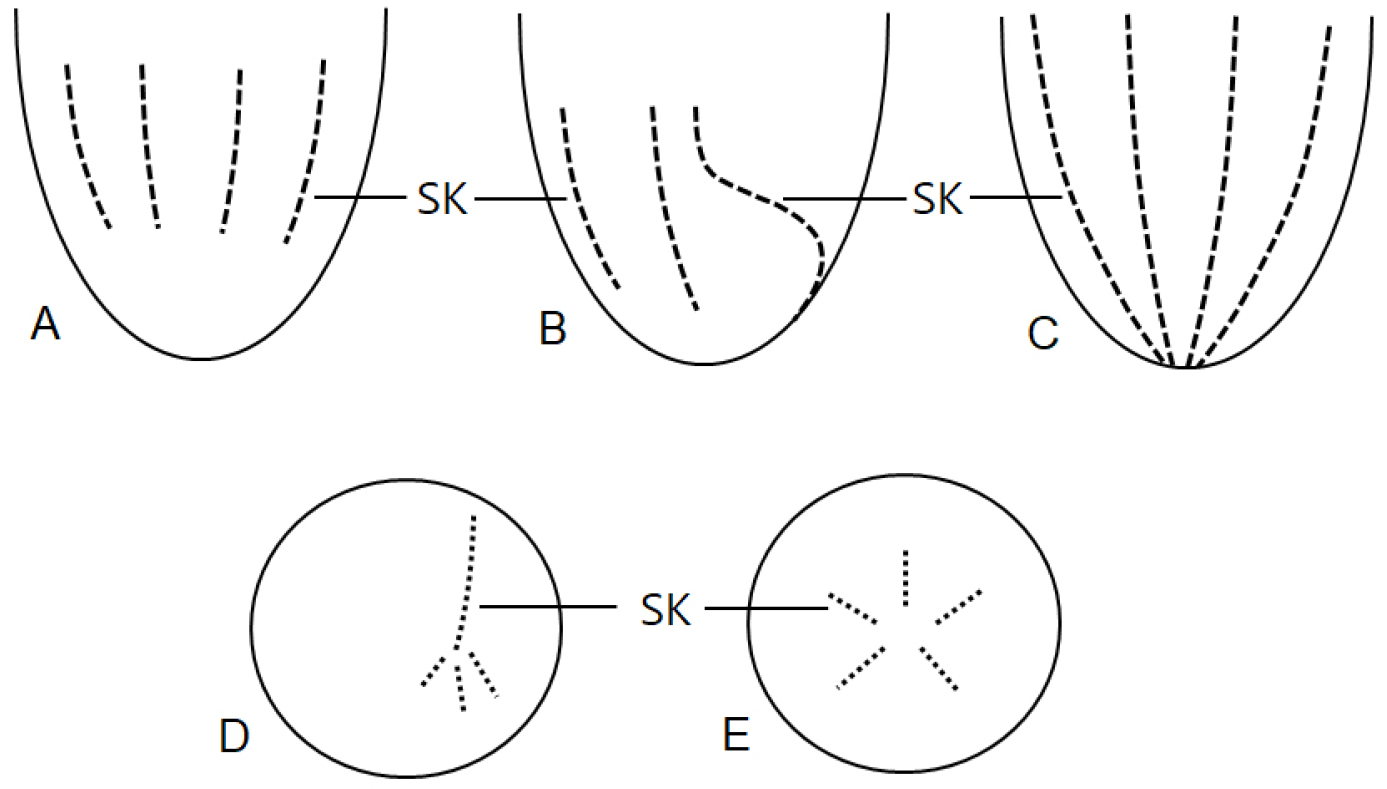
소모류는 구부에 둘러있는 경부막판(collar membranelles)의 개폐에 따라, 크게 두 그룹, 개구환소모류(Oligotrichia)와 폐구환소모류(Choelotrichida)로 구분하고 있다(Fig. 6). 개구환소모류는 꼬리(tail)의 유무에 따라 꼬리가 없는 그룹을 민소모류(Strombidiidae), 꼬리를 가지고 있는 경우를 꼬리소모충(Tontoniidae)으로 분류한다. 특히, 민소모류의 경우는 섬모열이 매우 복잡하게 분화되어 18개의 속으로 최근 속의 분류가 제시된 바 있다(Liu et al. 2015). 꼬리소모충도 환섬모열(girdle kinety)의 배열에 따라 4개의 속으로 구분하고 있다(Fig. 7). 반면에 개구환소모류에 비해 섬모열의 분화는 심하지 않으며, 가장 중요한 분류 특징인 체섬모열(somatic kinety)의 배열에 따라 속(genus)의 분류가 결정된다(Fig. 8).
국내 해역에 출현하는 유종섬모류와 소모류의 종동정은 우점적으로 출현하는 종들을 정리하여 종의 형태를 기재한 도감을 참고할 수 있다(Kim and Choi, 2016; Kim and Lee, 2016).
6.4 개체수 산정
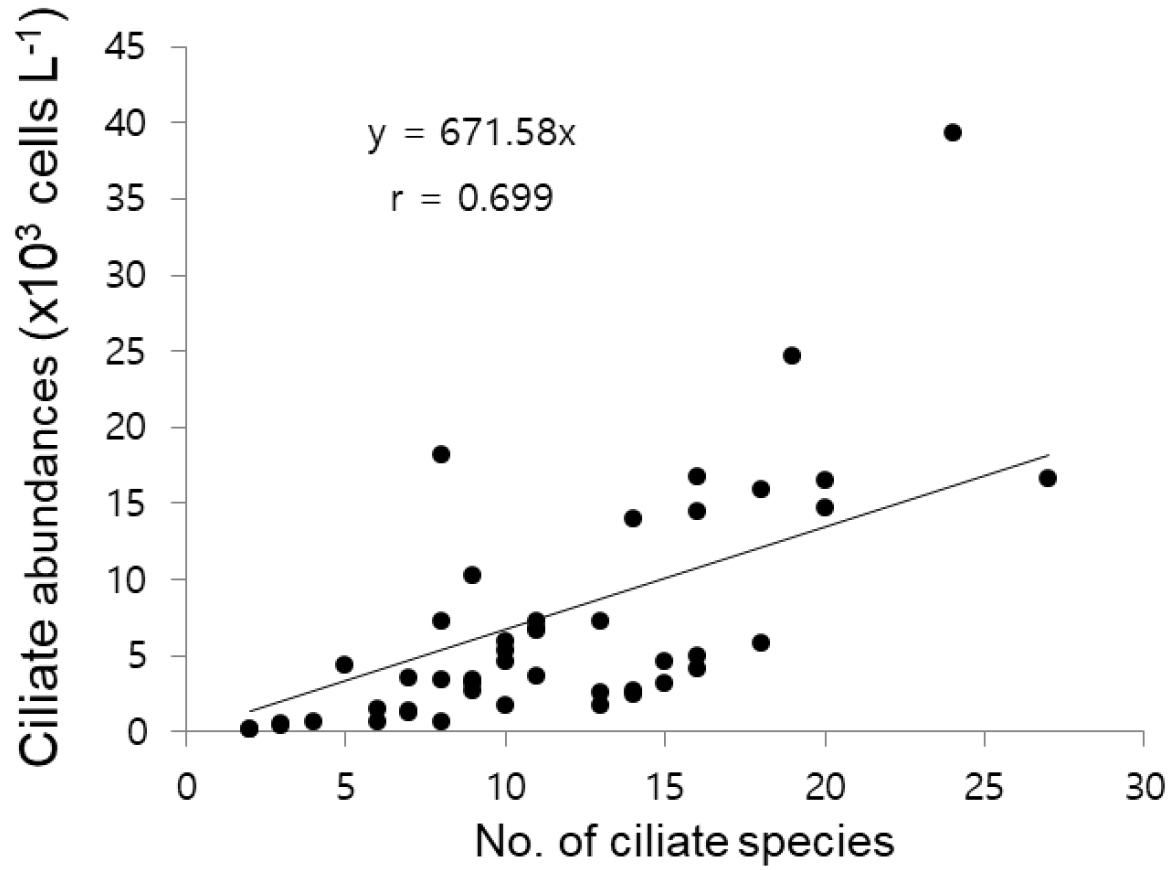
섬모충플랑크톤의 개체수는 계수판 위에 놓인 고정농축시료 1 mL 속에 들어 있는 세포수를 계수한 후, 농축된 비율을 적용하여 해수부피 단위 리터(L) 속에 들어 있는 세포수(cells L-1)로 표현한다. 국내연안 해역에서는 보통 102-103 cells L-1의 수준으로 분포하며, 대발생의 경우 104 -106 cells L-1의 고밀도 개체수 범위로 출현하며, 부영양화수역에서 먹이원이 풍부한 경우에 소형종이 고밀도 개체수 출현이 보고되었다(Fig. 9). 일반적으로 유종섬모류 개체수는 고수온기에 높고 저수온기에 감소하는 국내해역에서 계절성을 뚜렷이 보인다(Kim and Jang, 2008; Kim et al., 2007, 2012).
소모류의 경우는 Bouin 고정시료를 여과지 위에 일정량을 여과한 후에 여과지 위에 놓인 세포를 QPS 염색한 후, 종을 동정하고 동시에 계수한다(Montagnes and Lynn, 1987). 연안 해수의 경우, 10-50 mL의 시료를 여과한 시료를 염색하여 관찰함이 바람직하나, 채집시료의 상태에 따라 적정 여과량을 정해야 한다. 여과한 해수 부피를 환산하여 개체수는 해수부피 단위 리터(L) 속에 들어 있는 세포수(cells L-1)로 표현한다. 그러나 현시점 QPS의 어려움으로 종수준의 계수는 어렵기 때문에, 중성루골 용액으로 고정된 세포를 크기별로 나누어 정량 자료를 확보 할 수 있다.
6.5 유전자 분석
섬모충플랑크톤의 정성분석은 단일종을 분리배양하여 형태관찰과 더불어 다양한 유전자 분석을 실시하는 것은 분류학적 연구 측면에서 가장 이상적이다. 그러나 대다수의 부유성 섬모충류 종은 장시간 안정적인 배양이 어렵기 때문에 현장시료로부터 개체를 직접 분리하여 형태관찰과 유전자 분석을 동시에 수행하는 방법이 보편적이다. 유종섬모충류의 경우는 현장시료로부터 종의 확보가 비교적 용이하기 때문에 형태적 유사종의 오염을 배제하기 위해 단세포 중합효소 연쇄반응(polymerase chain reaction, PCR)으로 종별 유전자 정보를 얻을 수 있다. 근연종의 비교 및 계통분석에 유용한 ribosomal DNA (rDNA) 유전자를 얻을 수 있으며 18S, 28S, ITS1, 5.8S 그리고 ITS2 부위가 포함된다. 소모류의 경우는 현장 채집시료를 바로 현미경 관찰로 종의 구별은 불가능함으로, 현장시료로부터 개체를 분리하여 일정기간 배양하여 개체를 증식시킨 후, 배양된 개체를 윌버트 방법으로 염색하여 형태적 종을 구분하고, 일부 배양 개체는 PCR로 분석하여 종을 검증하여 유전자 정보를 얻고 있다.
유전자 분석시료는 최소농도 70% 이상이 되도록 에탄올에 고정한다. 고정시료는 멸균증류수로 이물질과 고정액을 세척한 후, 현미경하에서 미세피펫으로 세포를 분리하여 관찰한 후, 형태적 종동정을 먼저 실시한다. 향후 실험결과의 검증을 위해 가능한 여러 개체를 확보하여 각각 PCR 분석을 한다. 세척된 개체는 PCR 튜브에 담아 준비하고 PCR 혼합물(mixture)를 넣고 DNA 추출 과정 없이 제조사 방법대로 PCR을 수행한다(Kim et al., 2013). 여분의 고정시료는 –20℃의 냉동고에 보관하여 추후 필요 시 사용할 수 있다.
PCR 수행은 Jung et al.(2011)의 방법을 따라 EuKA (5′-AAC CTG GTT GAT CCT GCC AGT-3′)와 rev2 (5′-ACG ATC GAT TTG CAC GTC AG-3′) 혹은 rev4를 증폭 프라이머로 사용한다(Table 1). PCR 조건은 94°C에서 2분 처리 후, 95°C에서 30초, 50°C에서 40초, 72°C에서 4분의 과정을 37회 반복하고 마지막으로 72°C에서 10분간 처리한다. 이 조건으로 18S rDNA와 ITS1, 5.8S, 그리고 28S rDNA 일부분을 포함하는 약 3 kb의 PCR 산물을 얻을 수 있다. 이후 PCR산물의 정제와 클로닝은 일반적인 유전자분석 수행과 동일하게 한다. 증폭된 PCR산물의 염기서열 분석은 상업적인 서비스가 보편적이며, 염기서열분석 프라이머는 Table 1과 같다.
Table 1.
List of seqencing primers
| Primer name | Sequence (5′– 3′) | Characters | Reference |
| EUKA | AAC CTG GTT GAT CCT GCC AGT | Forward | (Medline et al., 1988) |
| EUKB | TGA TCC TTC TGC AGG TTC ACC TAC | Reverse | (Medline et al., 1988) |
| Pro930 | GGT TAA AAA GCT CGT AGT | Forward | (Gong et al., 2007) |
| NSR951 | TTG GYR AAT GCT TTC GC | Reverse | (Wuyts et al., 2004) |
| NSF1419 | ATA ACA GGT CTG TGA TGC CC | Forward | (Wuyts et al., 2004) |
| ITS1 | TCC GTA GGT GAA CCT GCG G | Forward | (White et al., 1990) |
| ITS4 | TCC TCC GCT TAT TGA TAT GC | Reverse | (White et al., 1990) |
| rev2 | ACG ATC GAT TTG CAC GTC AG | Reverse | (Sonnenberg et al., 2007) |
| rev4 | GTT AGA CTY CTT GGT CCG TG | Reverse | (Sonnenberg et al., 2007) |
섬모충의 분자계통분석에는 18S rDNA가 가장 많이 쓰이고 있으며, 최근 해양 유종섬모충 분석을 위해서 28S rDNA가 추가 분석에 이용되고 있다. 분석의 목적에 따라서 얻어진 유전자에서 일부 변이지역(V2, V4, D2)을 선택하여 계통분석에 이용하거나 유전자간 유사도 분석 등에 이용하기도 한다. 계통분석에 사용되는 프로그램은 연구대상과 연구자에 따라 상이하나, 최근에는 MrBayes와 PhyML, RAxML 등의 프로그램이 주로 사용된다(Guindon et al., 2010; Ronquist et al., 2012; Stamatakis, 2014). 분자계통 분석 방법은 지속적으로 개선되어 최신연구에서 제시되고 있다. 연구 목적과 분석 도구에 따라서도 다르기 때문에 표준화하여 제시하는 것은 어렵다. 분석하고자 하는 분류그룹을 대상으로 국제저널에 게재된 최신 연구를 참고할 것을 권장한다.
6.6 분석기술의 고급화
최근에 기존의 세포염색법과 달리, 형광염색을 통해 공초점현미경을 활용하여 섬모열 분석이 섬모충 연구에 소개된바 있으나(Tassin et al., 2016), 종 수준의 분석을 위해서 특히, 섬모충플랑크톤 분야의 적용은 관련 분석기술이 축적이 필요하다. 원생생물은 마이크로마이옴과 같은 최근 각광을 받는 연구분야의 주요 대상 생물군이다(Gao et al., 2019). 따라서 단 세포와 중수준의 유전자 분석에서 범위를 넓혀 섬모충플랑크톤의 환경유전자(eDNA) 분석을 통해 대량의 정보를 확보하고, 나아가 인공지능의 분석기술을 접목시켜 자료 해석을 도모할 수 있다.
원생생물의 일부 종들은 정량과 정성분석을 동시에 현장에서 수행하는 방법으로 FlowCam과 Flow Cytobot과 같은 최신 장비를 활용한 사례들이 있다(Olson and Sosik, 2007; Kydd et al., 2018). 섬모충플랑크톤도 관련된 분석기술이 개발된다면 현장 모니터링의 수월성과 정확성을 높일 수 있다.
7. 결 론
섬모충플랑크톤은 환경변화에 민감한 단세포 생물군으로 한반도 주변해역의 수온상승에 따른 해양생태계 구조변화를 파악하기 위한 모델생물로써 활용할 수 있다. 그러나 이 같은 활용성은 먼저 섬모충플랑크톤 자료 분석의 정확성이 전제되어야 한다. 자료의 정확성은 적절한 연구방법에 의해 결정되지만, 현실적으로 연구자들에게 수용이 어려운 범위가 있다. 따라서 섬모충플랑크톤 연구 수월성을 확보하기 위해 국내의 해산 섬모충플랑크톤 연구 시, 자료의 정도관리를 위한 절충적 방법을 다음과 같이 제안한다. 유종섬모류의 정량과 정성 분석은 중성루골 고정시료의 현미경 관찰에 의한 피갑형태를 기준으로 종동정과 종의 개체수를 산출함을 권장한다. 소모류의 경우 세포염색이 현시점 한계가 있음으로 크기별 분획에 의한 개체수 산출을 권장하며, 분류학적 연구의 경우에는 직접 제조된 프로타골 분말을 윌버트 방법에 의해 세포를 염색하여 섬모열 분석을 통해 종동정을 권장한다. 향후 소모류의 개체수 분석도 종수준까지 가능하도록 핵심 염색시약인 은단백질화합물의 시판 재개 또는 직접 제조법의 향상이 필요하며, 최신 장비와 기술을 섬모충플랑크톤 분석에 활용할 수 있도록 미래 연구를 기대한다.